مطالعه اخیر دانشمندان دانشگاه رایس نشان داده است، نانوذرات تزریقی میتوانند فرد آسیبدیده را از آسیب بیشتر توسط استرس اکسیداتیو حفاظت کنند. درست زمانی که سوپراکسید دیسموتاز کارآمد نیست.
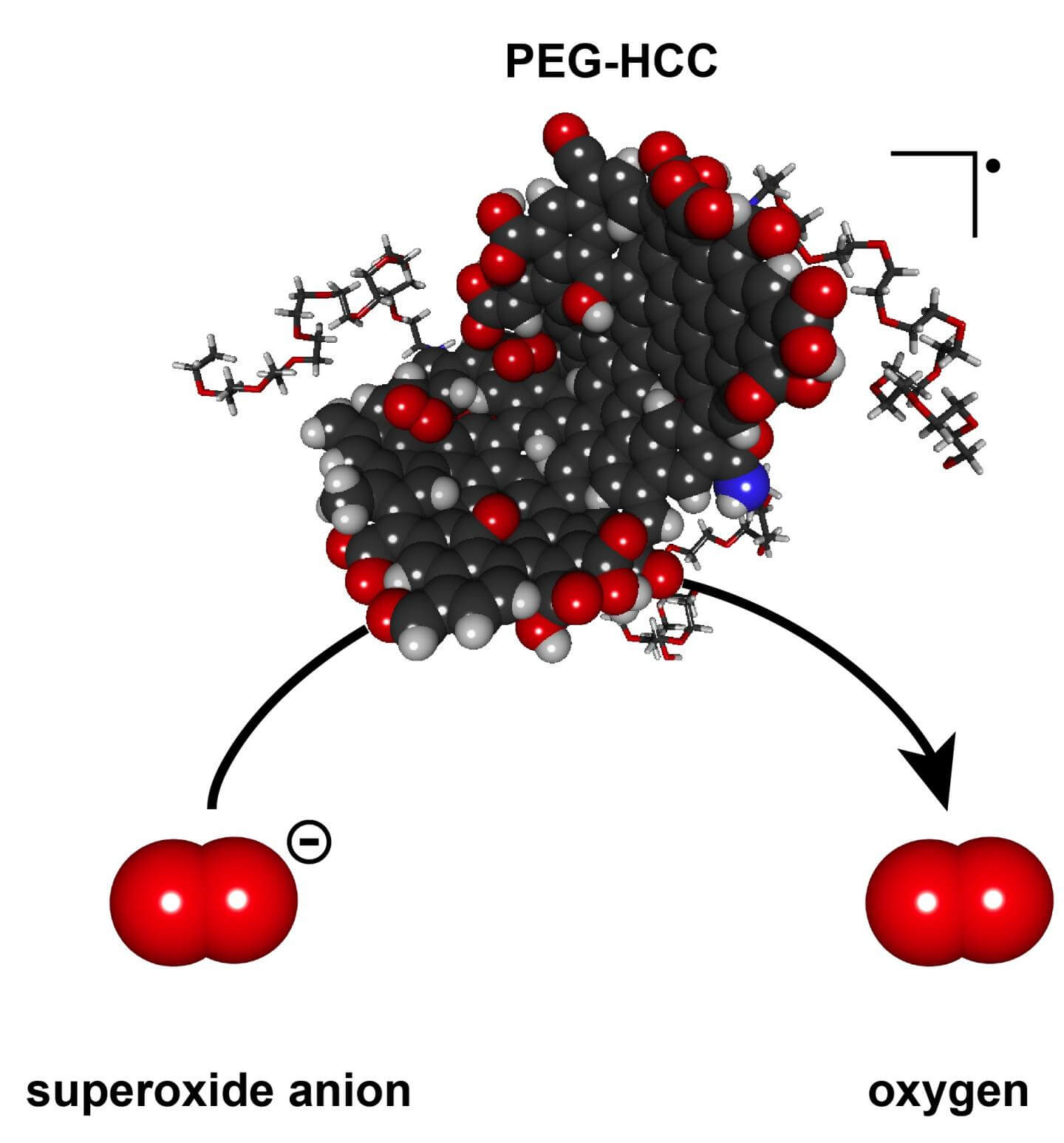
محققین دانشگاه رایس، کالج پزشکی بِیلور و مرکز علوم سلامت تگزاس مطالعهای برای بررسی اثرات اختراع سال ۲۰۱۲ خود طراحی نمودهاند. این ماده که ترکیبی از کلاسترهای هیدروفیلی پلیاتیلن گلیکول است و بهاختصار PEG-HCC نامیده میشود، بهسرعت میتواند روند بیشاکسیداسیون (Overoxidation) را متوقف سازد. پروسه بیشاکسیداسیون میتواند طی دقایق و ساعات اولیه آسیب به بافت تخریبات زیادی را ایجاد کند.
این آزمایشها نشان میدهد یک نانوذره میتواند بهسرعت فرآیند خنثیسازی هزاران گونه فعال اکسیژن را انجام دهد. این گونههای فعال در نتیجه آسیب بافتی تولید میشوند و میتوانند باعث صدمه به سلولها و ایجاد جهشهای ژنتیکی شوند، اما PEG-HCC ظرفیت بسیار بالایی در تبدیل این گونههای بسیار فعال به مواد کمتر فعال دارد.
این محققین امیدوارند که در آینده یک تزریق PEG-HCC در کمترین زمان ممکن بعد از آسیبهای مغزی و سکته از آسیب بیشتر این بافت جلوگیری کرده و سطوح اکسیژن را در سیستم گردش حساس مغز به حالت نرمال برگرداند.
شیمیدان دانشگاه رایس، جیمز تور در این مورد میگوید: این مواد سریعا سطح گونههای فعال اکسیژن را به حالت طبیعی برمیگردانند. این ماده میتواند بهعنوان یک پاسخ اورژانسی در مقابله با بیماران دچار سکتههای قلبی یا مصدوم دچار تصادف و یا حتی سربازان در میدان جنگ مورد استفاده قرار گیرد.
نانوذرات PEG-HCC تقریبا ۳ نانومتر عرض و ۳۰ تا ۴۰ نانومتر طول دارند. این مواد بهطور متوسط از ۲۰۰۰ تا ۵۰۰۰ اتم کربن ساخته شدهاند. در آزمایشها یک نانوذره PEG-HCC به تنهایی توانست در یک ثانیه ۲۰ هزار تا یک میلیون گونه فعال اکسیژن را به اکسیژن مولکولی و پراکسید هیدروژن تبدیل میکند. اکسیژن مولکولی تولیدی در این واکنش مورد نیاز بافت آسیبدیده است.
دو نفر از نویسندگان همین مقاله، پیشتر مطالعهای در خصوص تزریق PEG-HCC غیر سمی داشتند که نشان داده است این تزریق میتواند جریان خون مغز را به پایداری برساند و از آن در مقابل مولکولهای گونههای فعال اکسیژن تولید شده در یک ترومای پزشکی همراه با خونریزی زیاد محافظت کند.
مطالعات آنها صدمات مغزی را هدف قرار میدهد، شرایطی که در آن سلولها مقادیر زیادی از گونههای فعال اکسیژن موسوم به سوپراکسیدها را به جریان خون ترشح میکنند. این سوپراکسیدها مولکولهایی با یکی الکترون منفرد هستند که سیستم ایمنی از آن برای کشتن میکروارگانیسمهای مهاجم استفاده میکند. در مقادیر کم، سوپراکسیدها برای تنظیم انرژی سلول مورد استفاده قرار میگیرند. در حالت کلی، مقادیر این سوپراکسیدها با آنزیم سوپراکسید دیسموتاز کنترل میشود. این آنزیم وظیفه خنثی کردن سوپراکسیدها را دارد.
اما حتی تروماهای خفیف میتواند به اندازهای سوپراکسید آزاد کند تا سیستم دفاعی مذکور را مغلوب سازد. در این حالت سوپراکسیدها میتوانند حالتهای دیگری از گونههای فعال اکسیژن مثل پروکسینیتریت را تشکیل دهند که آسیب بیشتری ایجاد میکنند.
منبع
Samuel EL, Marcano DC, Berka V, Bitner BR, Wu G, Potter A, Fabian RH, Pautler RG, Kent TA, Tsai AL, Tour JM. Highly efficient conversion of superoxide to oxygen using hydrophilic carbon clusters. Proceedings of the National Academy of Sciences. 2015 Feb 24;112(8):2343-8.