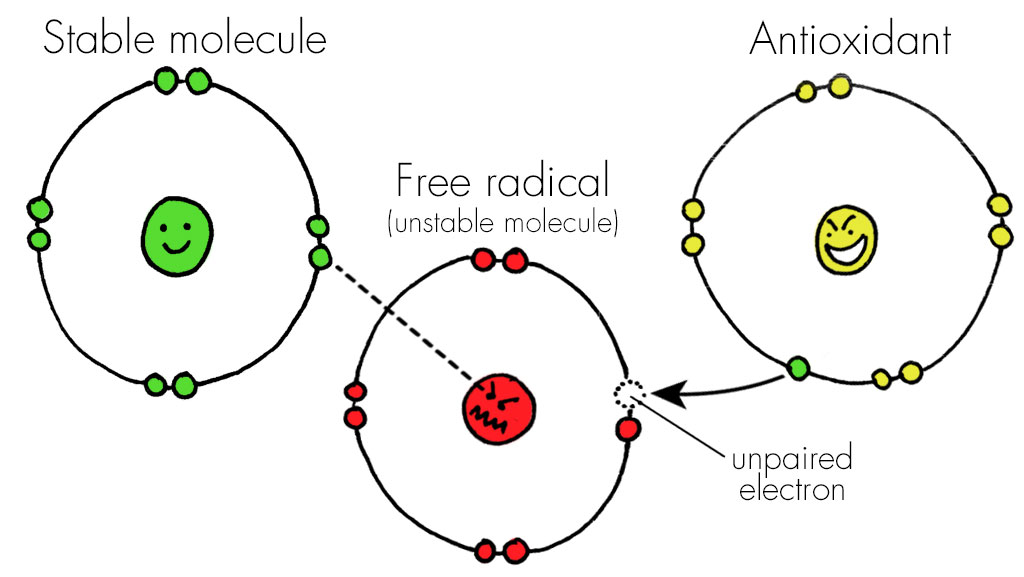
تولید بیش از حد گونههای فعال اکسیژن (ROS) در علل ناباروری، به خصوص ناباروری مردان در گیرند. ناباروری مشکلی است که در سراسر جهان وجود دارد و جوامع مختلف را درگیر میکند و پیامدهای روانی- اجتماعی آن گریبانگیر مردان و زنان نابارور است. ناباروری باعلت مردانه، حدود نیمیاز انواع ناباروری را به خود اختصاص داده است و یکی از معضلات فعلی جامعه بشری است. اولین قدم جهت تشخیص و درمان ناباروری، بررسی پارامترهای اسپرم میباشد که مهمترین آنها ارزیابی تعداد، تحرک و مورفولوژی اسپرم است. مطالعات متعددی نشان دادهاند که افراد نابارور با کاهش کیفیت پارامترهای اسپرمیمواجه هستند. اگر چه، 15 درصد از بیماران نابارور با فاکتور مردانه، آنالیز مایع منی آنها نرمال است. بنابراین، میتوان نتیجه گرفت که این موضوع به تنهایی برای ارزیابی پتانسیل باروری مردان کارآمد نیست. لذا علاوه بر ارزیابیهای معمول، چند آزمون پیشرفته از جمله ارزیابی سطح قطعه قطعه شدن DNA اسپرم و تراکم DNA را میتوان برای یافتن علل ناباروری انجام داد. با توجه به شواهد، قطعه قطعه شدن DNA اسپرم با تغییر در پارامترهای اسپرمیدر ارتباط است. علاوه بر این، با توجه به افزایش آسیب DNA اسپرم در مردان نابارور نسبت به مردان بارور میتوان نتیجه گرفت که این موضوع میتواند قدرت باروری مردان را تحت تأثیر قرار دهد. از این رو ارزیابی محتوای DNA اسپرم ممکن است برای آنالیز مایع منی مفید باشد و پیش بینی باروری برای مردان را ممکن سازد. چند فاکتور در اختلال محتوای DNA اسپرم دخیل هستند که از جمله آنها میتوان به عوامل محیطی و شیوه زندگی، دخانیات، واریکوسل و استرس اکسیداتیو، اشاره نمود. مطالعات نشان میدهد که غلظت بالای ROS، با ناباروری در 40 درصد از مردان در ارتباط است و مطالعات جدید، سطح ROS بالا را در 80 ـ 30 درصد از مردان نابارور نشان دادهاند. غلظت بیش از حد ROS و استرس اکسیداتیو اثرات پاتولوژیکی را در دستگاه تناسلی مرد اعمال میکند که مخرب اسپرم هستند و ارتباط منفی با تغییر در غلظت، تحرک و مورفولوژی اسپرم دارد و میتواند منجر به ضعف اسپرم و در نهایت ناباروری آن شود. اگر چه ROS برای عملکردهای مختلف فیزیولوژیک مهم است اما مقادیر بیش از حد آن به استرس اکسیداتیو کمک میکند. مکانیسم عمل ROS شامل پراکسیداسیون لیپیدی غشاء پلاسمایی اسپرم است که به دلیل وجود مقدار زیاد اسیدهای چرب غیر اشباع در غشاء خود، بسیار مستعد ابتلاء به آسیبهای اکسیداتیو است و این موضوع میتواند روی تحرک اسپرم، سیالیت غشا و توانایی لقاح آن اثر منفی گذارد. علاوه بر این ROS میتواند به پروتئینهای اکسونم اسپرم صدمه بزند و باعث تسریع و شتاب مصرف ATP گردد و در عملکرد میتوکندری و DNA اختلال ایجاد کند.
همچنین قرار گرفتن در معرض استرس روانی اجتماعی با افزایش استرس اکسیداتیو و التهاب در پلاسمای مایع منی همراه است که در نهایت منجر به کاهش کیفیت اسپرم میشود. لذا احتمال کاهش باروری در این افراد بیشتر گزارش شده است و جهت درمان آنها از تکنیکهای کمک باروری استفاده میگردد.
در روش کمک باروری از تکنیکهایی مانند: تلقیح داخل رحمیاسپرم (IUI)، لقاح آزمایشگاهی (IVF) و تزریق درون سیتوپلاسمی اسپرم (ICSI)(Intracytoplasmic0Sperm-Injection) استفاده میشود. در حقیقت هدف از ART افزایش شانس باروری از طریق نزدیک کردن یا حتی وارد کردن اسپرم به تخمک است که بدین وسیله میتوان از برخی نواقص عملکردی گامت نر گذر کرد. نکته مهمیکه باید به آن توجه داشت این است که کیفیت پارامترهای اسپرم در طی آماده سازی جهت استفاده برای این تکنیکها باید حذف شود و اسپرمهای عملکردی از اسپرمهای غیرطبیعی که قادر به باروری تخمک نیستند، باید جدا شوند. دو روش معمول آماده سازی اسپرم که بیشتر در مراکز درمانی ناباروری استفاده میشوند که DGC (Density Gradient Centrifugation) و Swim up نام دارد که در طی آن پلاسمای منی که 90 درصد از منی را تشکیل میدهد، باید حذف گردد، یکی از این ترکیبات بسیار مهم پلاسما، آنتیاکسیدانهاا هستند که با حذف پلاسما در حین شستشو از اسپرم حذف میشوند، پس حذف این آنتیاکسیدانها و انجام سانتریفوژ در حین شستشو میتواند سبب تولید ROS گردد. علاوه بر این فریز- ذوب اسپرم، آسیب مکانیکی، شوک سرد و قرار گرفتن در معرض اتمسفر اکسیژن، به نوبه خود حساسیت به پراکسیداسیون لیپیدی را افزایش و سبب تولید ROSبیشتر میشود. همچنین این موضوع را نیز باید در نظر گرفت که نمونههای بیمارانی که برای درمان IVF یا ICSI به مرکز درمانی مراجعه میکنند، در صورتی که در مدت زمان بیش از یک ساعت بمانند، به دلیل حذف پلاسما که حاوی آنتیاکسیدان است، در معرض ROS تولید شده توسط سلول ها قرار گرفته و با افزایش میزان آسیب DNA نسبت به اسپرم افراد بارور رو به رو خواهند شد و در کمک باروری، اسپرم با DNA آسیب دیده، نرخ لقاح و حاملگی را کاهش میدهد و در رشد جنین اختلال ایجاد میکند و خطر سقط جنین خود به خود، تولد نوزاد ناقص و بیماریهای دوران کودکی مانند سرطان را افزایش میدهد.
منابع:
- Mehta, A., Esteves, S.C., Schlegel, P.N., Niederberger, C.I., Sigman, M., Zini, A. and Brannigan, R.E., 2018. Use of testicular sperm in nonazoospermic males. Fertility and sterility, 109(6), pp.981-987.
- , M. Amirzadegan M. Tavalaee , M.H. Nasr-Esfahani, Oxidative Stress and Its Effects on Male InfertilityM. Arbabian