تکنیک الکتروفورز، مولکولها را بر اساس بار الکتریکی در میدان الکتریکی جدا میکند. تحرک یک مولکول به شکل معکوس متناسب با اندازه آن است و به طور مستقیم با شارژ آن متناسب است. در طول الکتروفورز، پروتئینها به سمت یک الکترود متناسب با بار الکتریکی در میدان الکتریکی حرکت میکنند. سرعت حرکت مولکولها در یک سیستم الکتروفورز علاوه بر خواص ذاتی مانند اندازه، شارژ و شکل پروتئینها، بر اساس عوامل متعددی نظیر دما، pH و غلظت بافر نیز کنترل میشود. جداسازی الکتروفورز پروتئین به طور دقیق براساس وزن مولکولی آنها امکانپذیر است، اگر بار الکتریکی تمام مولکولهای پروتئین طبق روش مشخص یکسان باشد، در چنین مواردی تحرک مولکولهای پروتئینی تنها بر اندازه آنها متکی خواهد بود.
الکتروفورز ژل پلیآکریل آمید (PAGE) روش مبتنی بر این ایده است و برای جداسازی پروتئینها بر اساس اندازه آنها استفاده میشود.
اصول PAGE
در PAGE، مواد شوینده آنیونی به نام سدیم دودسیل سولفات (SDS) برای اتصال به پروتئینها استفاده میشود و به آنها بار منفی میدهد. سپس پروتئینها با توجه به اندازه پروتئین، در یک ماتریس ژل ساخته شده از پلیاکریلآمید در میدان الکتریکی به وسیله الکتروفورز جدا میشوند.
پلیاکریلآمید به عنوان فرآورده واکنش پلیمریزاسیون بین اکریلآمید و متیلنبیساکریلآمید ( BIS ) و با استفاده از کاتالیزور تولید میشود. درجه پلیمریزاسیون یا اتصال متقاطع را میتوان با تنظیم غلظت آکریلآمید و BIS کنترل کرد. ماده بیشتر منجر به ژل سختتر میشود. سختی ژل، به نوبه خود، اصطکاک ماکرومولکولهارا در ژل افزایش داده و در زمان عبور از طول ژل، بر جداسازی آنها تاثیر میگذارد.
ژلهای با درصد پایین (4-8٪ آکریلآمید) اجازه میدهند مولکولهای با وزن مولکولی بالاتر بتوانند از طریق ژل سریع حرکت کنند، در حالی که ژلهای سخت و با درصد بالا (12-20٪ آکریلآمید) انتقال مولکولهای بزرگ را محدود میکنند و به طور انتخابی به مولکولهای کوچک اجازه میدهند که از طریق ژل حرکت کنند.
پروتکل SDS-PAGE
- آمادهسازی نمونه:
نمونههای پروتئین با گرم کردن آنها با SDS مواد شوینده و مرکاپتواتانول دناتوره میشوند. این ماده محکم به پروتئینها متصل شده و موجب افزایش بار منفی میشود، همچنین گروههای سولفیدریل را آزاد میکند و به همین دلیل زنجیرههای پلیپپتیدی دارای بار منفی نسبت به وزن میشوند. این فرایند به حرکت پروتئینها بر اساس اندازه آنها در الکتروفورز ژل کمک میکند.
- آمادهسازی ژل:
ژل الکتروفورز معمولا دارای چندین جزء شامل آکریلامید، BIS و بافر است. پرسولفاتآمونیوم، یک منبع رادیکال آزاد و یک تثبیتکننده برای شروع پلیمریزاسیون به مخلوط اکریلآمید اضافه شده است. BIS نیز برای تشکیل پیوندهای بین مولکولهای اکریلآمید افزوده میشود تا زمانی که ژل در نهایت تشکیل شود.
- الکتروفورز:
به عنوان یک جریان الکتریکی پروتئین اعمال میشود که دارای یک الکترود مثبت و یک الکترود منفی است. هر مولکول با سرعت متفاوت بر اساس وزن مولکولی آن حرکت میکند. مولکولهای کوچک به سرعت از طریق ژل حرکت میکنند و مولکول با وزن بالا دارای سرعت حرکت کمتر در طول ژل هستند. حرکت معمولا در ولتاژهای بالاتر سریعتر است. بعد از چند ساعت، مولکولهای پروتئینی بر اساس اندازه از هم جدا میشوند.
- رنگآمیزی :
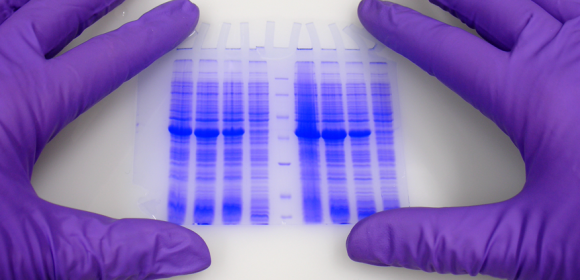
پس از تکمیل شدن الکتروفورز، ژل میتواند با استفاده از موادی رنگی مانند Coomassie Brilliant Blue یا اتیدیم بروماید رنگ شود تا پروتئینهای جدا شده به عنوان نوارهای متمایز رنگ بر روی ژل ظاهر شوند.
پس از رنگآمیزی، رنگ از ژل شسته شده سپس رنگبری میشوند تا شدت رنگ باندهای پروتئینی اندازهگیری شود. گروههای پروتئینهای رادیواکتیو با autoradiography میتوانند شناسایی شوند.
برخی از سیستمهای ژل یکرنگ مانند رنگ آمیزی بروموفنول همراه با نمونه پروتئین را معرفی میکنند – فاصله قابل مشاهده توسط رنگ بر روی ژل کمک میکند تا طول مدت الکتروفورز تعیین شود. بروموفنول آبی همراه با مولکولهای نمونه حرکت میکند تا زمانی که در نهایت به پایین ژل برسد. الکتروفورز نیاز به توقف در این مرحله دارد تا هیچ مولکول پروتئینی الکتروفورز از ژل خارج و بافر منتقل نشود.
منابع:
Kinoshita, E., Kinoshita-Kikuta, E. and Koike, T., 2009. Separation and detection of large phosphoproteins using Phos-tag SDS-PAGE. Nature protocols, 4(10), p.1513.
Wittig, I., Braun, H.P. and Schägger, H., 2006. Blue native PAGE. Nature protocols, 1(1), p.418.
