زمانی که آنتیاکسیدانها در بدن ضعیف میشوند و یا کاهش مییابند، سلولهای بدن و بافتها مستعد ابتلا به اختلالات عملکرد و بیماری میشوند بنابراین حفظ سطوح آنتیاکسیدانی کافی برای جلوگیری و یا حتی کنترل بسیاری از بیماریها ضروری است.
استفاده از ظرفیت آنتیاکسیدانی تام (TAC) ، در بیوشیمی، پزشکی، علوم تغذیه و در بسیاری از بیماریهای مختلف پاتوفیزیولوژی (بیماریهای قلبی و عروقی، دیابت، بیماریهای عصبی، روانپزشکی، اختلالات کلیوی و بیماریهای ریوی) میتواند به عنوان یک بیومارکر قابل اعتماد تشخیصی و پیش آگهی مورد مطالعه قرار بگیرد، اگرچه چندین توصیه برای سنجش آن باید مورد توجه باشد. مطالعه بیومارکرهای آنتیاکسیدانی دیگر نیز مانند عناصر پاسخ آنتیاکسیدانی ژنتیکی (ARE) و یا ویتامینهای آنتیاکسیدانی و دیگر بیومارکرهای ارزشمند اکسیداتیو / نیتروژنیک نیز میتواند برای ارزیابی مداخلات تغذیهای با غذاهای غنی از TAC در مورد خطر و پیشگیری از بیماری، از جمله استراتژی های ضد پیری مفید باشد.
رادیکالهای آزاد زمانی که بیش از حد تولید میشوند و یا در اثر کمبود آنتیاکسیدانها سطح بالایی در سلول دارند، میتوانند ساختار و عملکرد پروتئین را تغییر دهند و باعث پراکسیداسیون لیپیدها شده و باعث آسیب DNA گردد. تجزیه پراکسیدهای لیپید محصولات متنوعی را تولید میکند. از جمله آن، مالوندیآلدهید (MDA) یک محصول پراکسیداسیون لیپیدی است که به خوبی مطالعه و بررسی شده است. سطح MDA نشان دهنده میزان پراکسیداسیون لیپید به طور کلی است و به عنوان نشانگر آسیب سلولی در نتیجه حضور رادیکالهای آزاد عمل میکند.
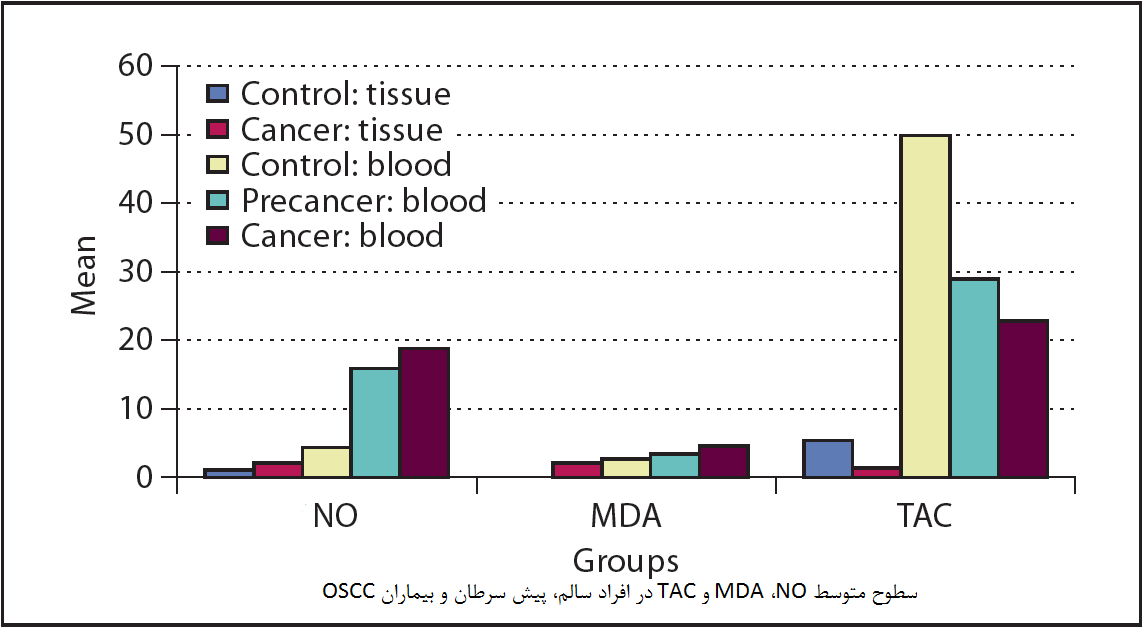
پراکسیداسیون لیپید ناشی از ROS در تغییرات بدخیم دخیل بوده و اهداف اولیه پراکسیداسیون توسط ROS اسید چرب غیر اشباع شده در چربیهای غشایی است. علاوه بر این، تجزیه این لیپیدهای پراکسیداسیون، انواع محصولات نهایی مانند MDA را تولید میکند. MDA به عنوان بیومارکر موتاژنیک و سرطان زایی مورد توجه قرار گرفته است. همچنین می توان از آن به عنوان بیومارکر تشخیص بیان ژنهای مربوط به پیشرفت تومور استفاده کرد. بنابراین، سطح MDA نشان دهنده میزان پراکسیداسیون لیپید به طور کلی است و به عنوان نشانگر آسیب سلولی حاصل از رادیکالهای آزاد عمل میکند. افزایش سطح MDA در بیماران OSCC ( سرطان سلولهای سنگفرشی دهان) نسبت به گروه شاهد مشاهده شده است. این افزایش در MDA ممکن است به علت شکلگیری رادیکال های آزاد بیش از حد و تجزیه اسیدهای چرب اشباعنشده موجود در غشاء باشد و یا ممکن است به علت اصلاح ناکافی رادیکالهای آزاد توسط سیستم آنتیاکسیدانی ضعیف سلولی باشد. افزایش سطح MDA و کاهش میزان TAC موجود در سرم و بافت بیماران OSCC در مطالعات به خوبی بررسی و اثبات شده است.
اثرات آنتیاکسیدانی NO-MDA با یکدیگر مرتبط هستند؛ NO باعث پراکسیداسیون لیپید میشود که به نوبه خود MDA را تولید میکند. فعالیت های MDA و NO در سرطان زایی بستگی به وضعیت آنتیاکسیدانی کل دارد. بدین ترتیب که این مکانیزمها به طور متقابل در ارتباط هستند، نیاز به مطالعه آنها با هم وجود دارد.
مطالعات نشان میدهد میزان استرس اکسیداتیو و نیتروژنیک در بیماران سرطانی دهان افزایش یافته و بیانگر سطح بالایی از NO و MDA و کاهش TAC به عنوان دفاع آنتیاکسیدانی اثبات شده است. افزایش سطح NO سرم و بافت منجر به پراکسیداسیون لیپیدها و در نتیجه باعث افزایش سطح سرمی و بافتی MDA میگردد. ارتباط مثبت NO-MDA نشان میدهد که DNA آسیب دیده در اثر اکسیداسیون، یک پدیده حیاتی برای سرطان زایی است که به دلیل تعامل ROS و RNS ( گونههای فعال نیتروژن) همراه با TAC رخ میدهد.
هم چنین در بیماران مزمن کلیوی، سطح MDA و گلوتاتیون اکسیدشده (GSSG) افزایش و غلظت GSH و GPx کاهش یافته که بررسیها در این بیماران سطح پایینی از TAC را نشان میدهد. بیماران مبتلا به صرع دارای گلوتاتیون ردوکتاز اریتروسیتوز و سطح ویتامینهای A و C پایین نسبت به گروه شاهد هستند و سطوح بالاتری از اریتروسیت MDA، سرولوپلاسمی و همولیز را نسبت به افراد کنترل نشان دادند که در این بیماران نیز TAC کاهش یافته است.
Pleural effusion لنفوسیتها در بیماران مبتلا به سرطان، کاهش سطح TAC و درجه بالاتری از آسیب اکسیداتیو DNA را نشان میدهد. کودکان مبتلا به سرطان استخوان، لنفوم Burkitt و لوسمی حاد ميلوئژن، سطح پلاسماي MDA بالاتري داشته و در زنان مبتلا به سرطان سینه ، بیماران مبتلا به فیبروآدنوم و آدنوکارسینوم پستان سطح پلاسما و اریتروسیت MDA افزایش یافته و غلظت GSH و ویتامین های C و E کاهش مییابد.
در نتیجه میتوان به این نکته اشاره کرد که با افزایش سطح رادیکالهای آزاد در سلول مانند NO و فعالیت اکسیداسیونی آن، سطح MDA به عنوان یک بیومارکر افزایش مییابد و سطح TAC که دفاع آنتی اکسیدانی در مقابل استرس اکسیداتیو محسوب میشود، در مقایسه با گروه شاهد کاهش معناداری را از خود نشان میدهد. سنجش میزان TAC سلولی میتواند به تشخیص و پیشآگاهی بیماری و میزان استرس اکسیداتیو سلولی در نتیجه حضور رادیکالهای آزاد منجر شود.
منابع:
Alipour, M., Mohammadi, M., Zarghami, N. and Ahmadiasl, N., 2006. Influence of chronic exercise on red cell antioxidant defense, plasma malondialdehyde and total antioxidant capacity in hypercholesterolemic rabbits. Journal of sports science & medicine, 5(4), p.682
Sies, H., 2007. Total antioxidant capacity: appraisal of a concept. The Journal of nutrition, 137(6), pp.1493-1495
Castillo, C., Hernandez, J., Valverde, I., Pereira, V., Sotillo, J., Alonso, M.L. and Benedito, J.L., 2006. Plasma malonaldehyde (MDA) and total antioxidant status (TAS) during lactation in dairy cows. Research in veterinary science, 80(2), pp.133-139
Samouilidou, E. and Grapsa, E., 2003. Effect of dialysis on plasma total antioxidant capacity and lipid peroxidation products in patients with end-stage renal failure. Blood purification, 21(3), pp.209-212
Korde, S.D., Basak, A., Chaudhary, M., Goyal, M. and Vagga, A., 2011. Enhanced nitrosative and oxidative stress with decreased total antioxidant capacity in patients with oral precancer and oral squamous cell carcinoma. Oncology, 80(5-6), pp.382-389.