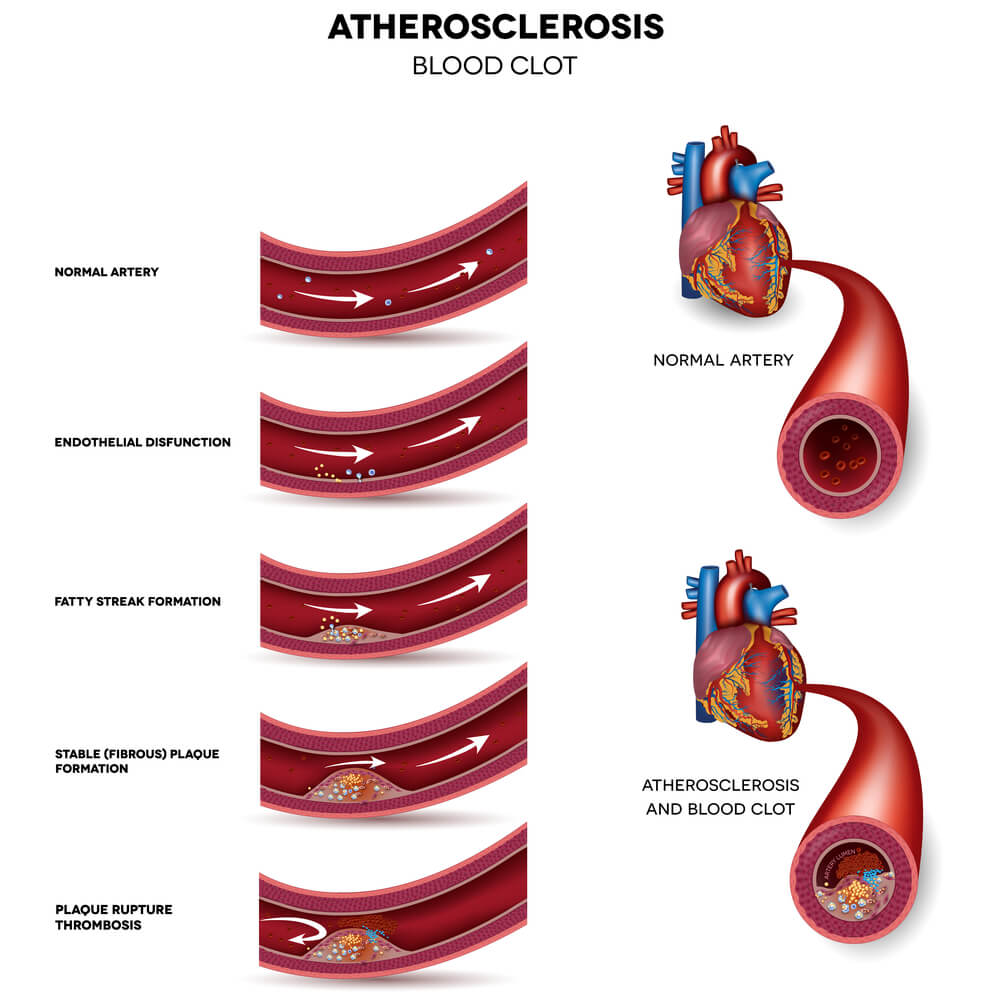
محققان UCLA دریافتند پروتئینی که نقش مهمی در برخی از داروهای آنتیاکسیدانی دارد، ممکن است به دلیل مکانیسمهای اضافی، موجب بروز آترواسکلروز و یا مسدود شدن عروق شوند. این یافته ممکن است سرنخهایی درباره اینکه چرا برخی از درمانهای آنتیاکسیدانی نتایج مثبت نداشتهاند، مفید باشد.
پروتئین Nrf2، به عنوان مهمترین هدف درمان دارویی برای بیماریهایی مانند سرطان به شمار میرود، زیرا میتواند با پیوستن به توالیهای خاص DNA، منجر به بیان ژنهای آنتیاکسیدانی و ضدالتهابی متعدد شده و فعالیت آنزیمهای درگیر در بروز سرطان را کاهش یا مهار کند. محققان معتقدند که Nrf2 با توانایی بالا ممکن است در جهت تقویت آنتیاکسیدانها، مبارزه با آسیب سلولی و بافت یا اکسیداسیون، مفید باشد که منجر به آترواسکلروز میشود.
با این حال، دانشمندان UCLA دریافتند در حالی که Nrf2 خواص آنتیاکسیدانی را در یک مدل حیوانی افزایش داد، همچنین با افزایش سطح کلسترول کل و میزان کلسترول در کبد، باعث افزایش آترواسکلروز میشود. به گفته محققان، این اولین مطالعه است که اثرات اضافی را بر متابولیسم کلسترول همراه با تشکیل پلاك در شریانها نشان میدهد. در واقع عوامل بروز آترواسکلروز بیشتر از مزایای آنتیاکسیدانی است. توسعه درمانهای آنتیاکسیدانی جدید بسیار مهم است و این تحقیق در درمانهای مبتنی بر این پروتئین تاثیر میگذارد.
برای مطالعه بیشتر جداسازی و شناسایی عملکرد Nrf2 ، بررسی متابولیسم و نقش آن در موشهایی که بدون پروتئین به طور خاص تولید میشوند انجام میگیرد. محققان دریافتند که موشهای نر بدون Nrf2 سطوح آنتیاکسیدانها را کاهش دادهاند، اما در مقایسه با حیوانات عادی، 53٪ کاهش در پلاکهای آترواسکلروز در آئورت مشاهده شد. موشهایی که تنها نیمی از بیان ژن برای Nrf2 را نشان میدادند، همان میزان تشکیل پلاک را داشتند.
سپس محققان تلاش کردند تا درک درستی از تاثیر پروتئین Nrf2 بر عوامل دیگر به دست بیاورند. دانشمندان متوجه شدند که موشهای بدون Nrf2 سطح کلسترول تام خون پایینتر و کلسترول کبدی کمتری دارند. کمبود پروتئین نیز منجر به کاهش بیان ژنهای درگیر در تولید و ذخیره چربی و تنظیم گلوکز در کبد میشود که بخشی از روند تولید کلسترول است.
یافتههای این تحقیق به اثرات جدید و مهم پروتئین Nrf2 در تنظیم تولید کلسترول و همچنین مسیرهای آنتیاکسیدانی اشاره دارد. ممکن است اثرات کلسترول در هنگام ایجاد درمانهای آنتیاکسیدانی با استفاده از این پروتئین مورد توجه قرار گیرد همچنین مقدار یا سطح بیان این ژن برای تعادل دو اثر مهم است.
علاوه بر این، محققان دریافتند که بیشتر اثرات Nrf2 در موشهای نر بسیار شایع است. برای بررسی اینکه آیا این اختلالات جنسی مدل حیوانات، مشابه انسان است یا خیر، مطالعات بیشتری لازم است و همچنین تحقیقات بیشتری در پاسخ به این سوال که آیا سایر عوامل محیطی، متابولیکی و ژنتیکی در تأثیر Nrf2 بر کلسترول و آنتیاکسیدانها نقش دارند، نیاز است.
منابع:
Seifried, H.E., Anderson, D.E., Fisher, E.I. and Milner, J.A., 2007. A review of the interaction among dietary antioxidants and reactive oxygen species. The Journal of nutritional biochemistry, 18(9), pp.567-579.
Tabas, I., 2010. The role of endoplasmic reticulum stress in the progression of atherosclerosis. Circulation research, 107(7), pp.839-850.
Matés, J.M. and Sánchez-Jiménez, F.M., 2000. Role of reactive oxygen species in apoptosis: implications for cancer therapy. The international journal of biochemistry & cell biology, 32(2), pp.157-170.