تحقیقات جدید نشان میدهد که بسیاری از زنان مبتلا به سرطان سینه تحت درمان، در صورت مصرف مکملهای آنتیاکسیدانی بهبودی بیشتری نشان میدهند.
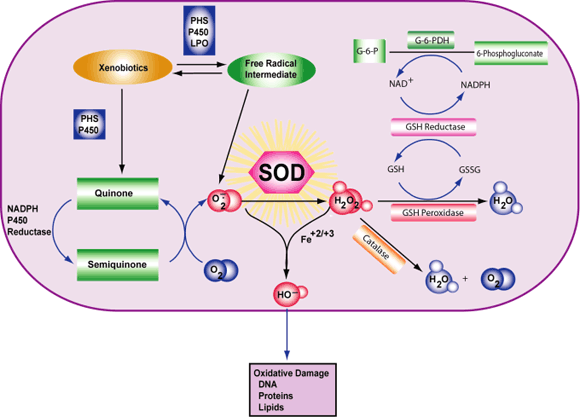
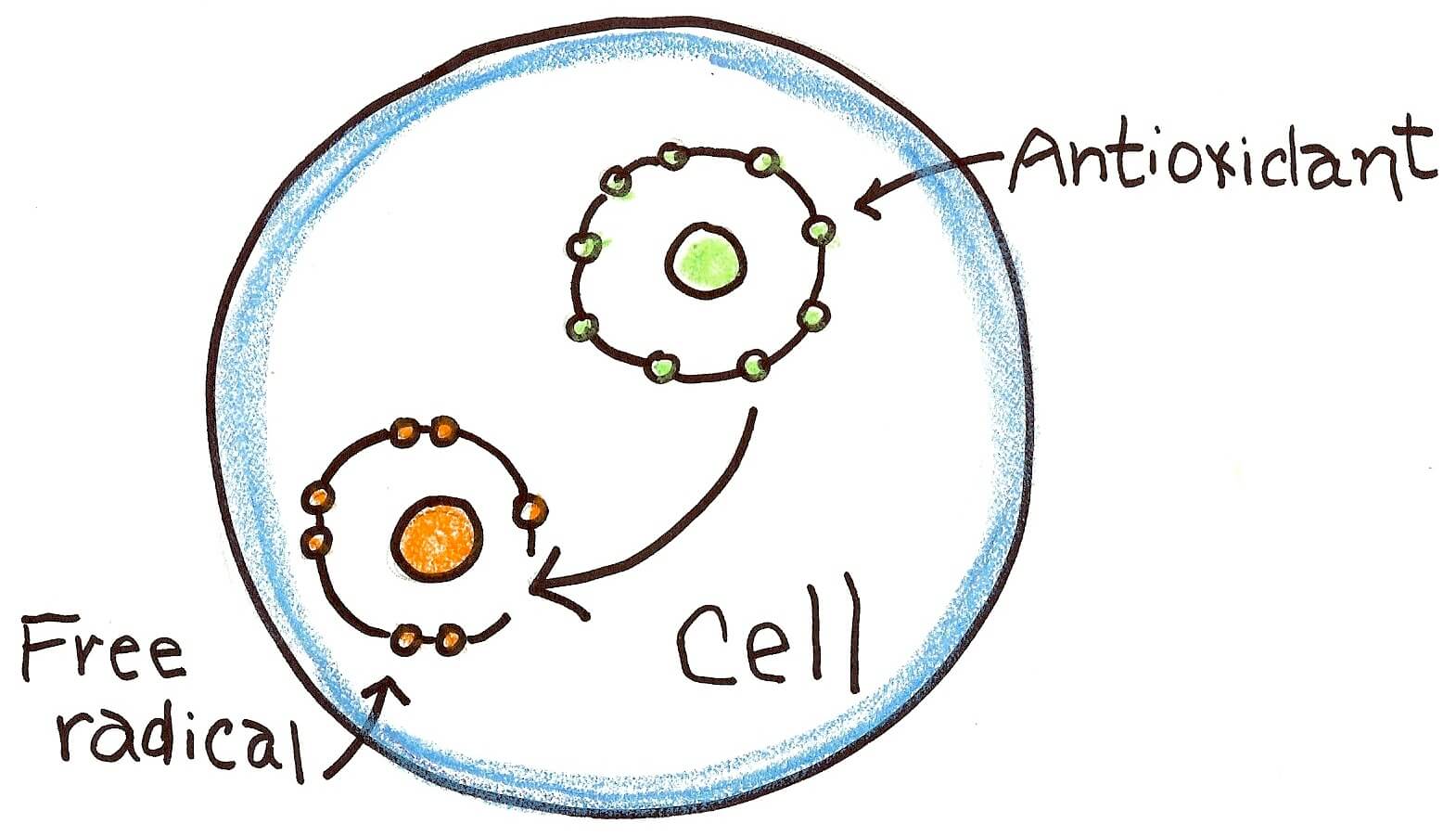
مکملهای آنتیاکسیدانی عبارتند از ویتامین C، ویتامین E، بتاکاروتن و سلنیوم. این آنتیاکسیدانها در مکملها و همچنین در بسیاری از مولتیویتامینها یافت میشوند. بسیاری از بیماران مبتلا به سرطان سینه بر این باورند که مکملهای آنتیاکسیدانی آنها را از عوارض جانبی درمان سرطان سینه محافظت کرده، به جلوگیری از بازگشت سرطان سینه کمک و سلامت کلی آنها را بهبود میبخشد. با این حال، اثرات واقعی مصرف آنتیاکسیدانها در طول درمان سرطان به خوبی مشاهده میشود. بعضی پزشکان بر این باورند که آنتیاکسیدانها در حقیقت میتوانند با پرتودرمانی و برخی انواع شیمیدرمانی مرتبط باشند که اغلب سلولهای توموری در حضور گونههای فعال اکسیژن (ROS)ایجاد شدهاند. ROS مولکولهای بسیار کوچک هستند که در توسعه سلولی نقش دارند.
محققان میزان نقش آنتیاکسیدان را در زنان مبتلا به سرطان سینه مورد بررسی قرار دادند. پروژه مطالعه سرطان سینه که شامل بیش از 1500 بیمار مبتلا به سرطان، به عنوان یک مطالعه موردی صورت گرفت.
در میان 764 بیمار مورد مطالعه، 663 زن (8/86 درصد) با شیمیدرمانی، پرتودرمانی یا هورموندرمانی برای سرطان سینه درمان شدند. از این تعداد زن، 6 در 10 (5/60 درصد) از آنتیاکسیدانها در طی درمان سرطان سینه استفاده کردند که شامل شیمی درمانی، پرتودرمانی و درمان تاموکسیفن (ضد استروژن) بود.
حدود هفت نفر از 10 نفر از آنتیاکسیدانها (3/69 درصد) در دوزهای بالا استفاده کردند که بیشتر از دوزهای موجود در مولتی ویتامین Centrum است. زناني كه در طول درمان مقدار زيادي از آنتياكسيدانها مصرف كردند احتمال بيشتري داشتند كه از تاموكسيفن استفاده كنند و مهمتر اینکه سابقه مصرف ميوه و سبزيجات بيشتر، استفاده از محصولات گياهي و قدرت ذهنی بالاتری داشتند.
با توجه به استفاده معمول از مکملهای آنتیاکسیدان در طول درمان سرطان سینه، اغلب در دوزهای بالا و در کنار سایر درمانهای مکمل، تحقیقات آینده باید بر اثرات مکملهای آنتیاکسیدانی بر پیامدهای سرطان سینه متمرکز باشد از جمله اینکه آیا آنتیاکسیدانها بر روی سمیت درمان، اثربخشی درمان و بازگشت مجدد این بیماری تاثیر دارند؟
منابع:
Greenlee, H., Hershman, D.L. and Jacobson, J.S., 2009. Use of antioxidant supplements during breast cancer treatment: a comprehensive review. Breast cancer research and treatment, 115(3), pp.437-452.
Lockwood, K., Moesgaard, S., Hanioka, T. and Folkers, K., 1994. Apparent partial remission of breast cancer in ‘high risk’patients supplemented with nutritional antioxidants, essential fatty acids and coenzyme Q10. Molecular aspects of medicine, 15, pp.s231-s240.
Nechuta, S., Lu, W., Chen, Z., Zheng, Y., Gu, K., Cai, H., Zheng, W. and Shu, X.O., 2010. Vitamin supplement use during breast cancer treatment and survival: a prospective cohort study. Cancer Epidemiology and Prevention Biomarkers, pp.cebp-1072.