مطالعه جدیدی انجام شده که سوالات جالبی در مورد یکی از نظریههای پیری (افزایش تولید رادیکالهای آزاد) مطرح میکند.
این مطالعه نشان داده است که حداقل برای کرمها، رادیکالهای آزاد مضر نیستند. در کرم C.elegans که از باکتریها برای تغذیه استفاده میکند، تغییرات ژنتیکی در جهت افزایش سطوح رادیکالهای آزاد عمل میکنند و نهتنها تحدیدی برای زندگی این کرم محسوب نمیشود بلکه باعث افزایش طول عمر این جاندار است. ویتامین C به عنوان یک آنتیاکسیدانت باعث ایجاد آسیب در کرم شده و سم پاراکوات -که اثرات خود را بهواسطه افزایش رادیکالهای آزاد اعمال میکند باعث رشد بهتر این کرم میشود. این کرم در حضور پاراکوات بیشتر عمر میکند و این مساله تا حدی جدی شده است که در کشورهای عضو اتحادیه اروپا استفاده از این سم ممنوع شده است.
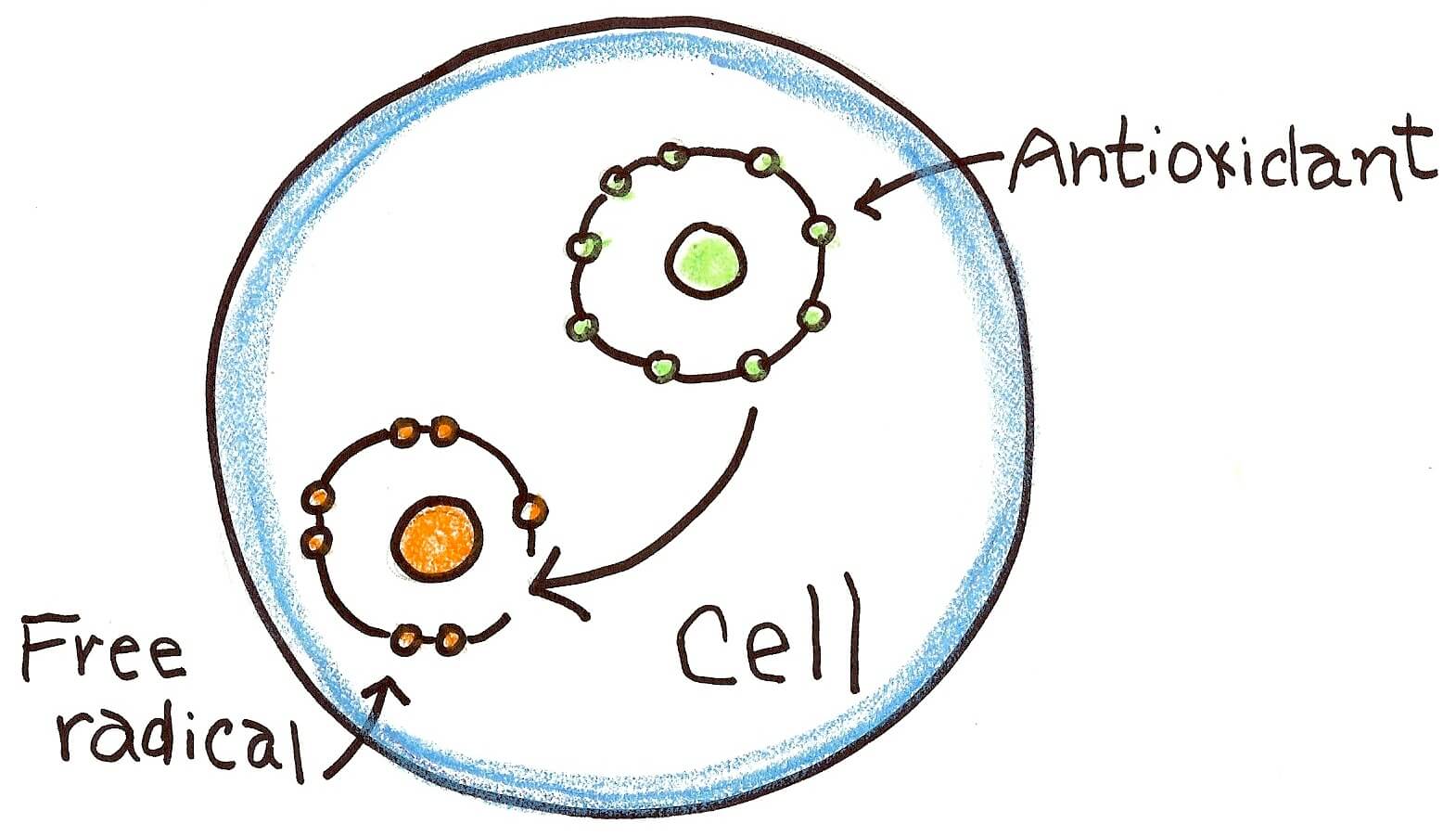
رادیکالهای آزاد مولکولهایی هستند که در بدن انسان طی فرآوری اکسیژن تولید میشوند. بسیاری از پستانداران برای ادامه حیات اکسیژن مصرف میکنند و به عنوان یک فرآورده فرعی رادیکالهای آزاد تولید میکنند که ممکن است برای سلولها مضر باشد. به این فرآیند استرس اکسیداتیو گفته میشود، که فرآیندی تجزیهکننده در سلول است. اینها همه دلایلی برای تبدیل عبارت «استرس اکسیداتیو» به یک زنگ خطر در پزشکی و طب مکمل شده است.
یکی از تئوریهای معروف پیری عنوان میکند که در طی پیشرفت عمر، تولید رادیکالهای آزاد افزایش مییابد که در نتیجه باعث افزایش صدمات سلولی میشود که در یک چرخهی معیوب دوباره خود باعث افزایش رادیکالهای آزاد میشود. مصرف آنتیاکسیدانتهای تغذیهای میتواند به معکوس کردن این چرخه کمک کند.
دکتر سیگفراید هِکیمی، پژوهشگر بخش زیستشناسی دانشگاه مکگیل میگوید: این یافتهها فهم ما از نقش رادیکالهای آزاد در پیری را به چالش میکشد. این تئوری بسیار ساده و منطقی است، اما یافتههای ما نشان میدهد که چارچوب متفاوتی در خصوص ارتباط استرس اکسیداتیو و پیری وجود دارد. مطالعات بیشتری برای درک این چارچوب مورد نیاز است. رادیکالهای آزاد قطعا در این فرآیند دخیل هستند اما ممکن است این دخالت در مسیری متفاوت از آنچه همه متصور هستند اتفاق میافتد.
یادداشت: ممکن است پدیده Hormesis یا انطباق که قبلا راجع به آن مطلبی نوشتهایم در این فرآیند تاثیر داشته باشد.
منبع:
Van Raamsdonk JM, Hekimi S (2009) Deletion of the Mitochondrial Superoxide Dismutase sod-2 Extends Lifespan in Caenorhabditis elegans. PLoS Genet 5(2): e1000361. https://doi.org/10.1371/journal.pgen.1000361