بیماری مزمن کلیوی (Chronic Kidney Disease(CKD؛ یکی از شایعترین بیماریهای امروزی است. CKD یک سندرم چند علامتی است که در نتیجه کاهش دائمی تعداد نفرونهای فعال (یا آسیب دائمی آنها) ناشی از فرآیندهای پاتولوژیک در پارانشیم کلیه اتفاق میافتد. این مشکل به ویژه در کودکان بسیار مهم است ، زیرا CKD مدت زمان طولانی هیچ علائم بالینی را نشان نمیدهد. بنابراین، این بیماری اغلب فقط در مراحل شدید تشخیص داده میشود که نیاز به درمان جایگزینی کلیوی دارد. بنابراین تعجبآور نیست که CKD گاهی اوقات به عنوان یک چالش برای کودکان در قرن بیستویکم توصیف میشود. شایعترین علل بیماری مزمن کلیه در کودکان نقص ادراری (حدود 30٪) ، گلومرولوپاتی (حدود 25 تا 30٪) ، نفروپاتی مادرزادی (حدود 20٪) و دیسپلازی کلیه (حدود 10٪) است. با توجه به افزایش مداوم تعداد كودكان مبتلا به CKD (از جمله بیماران دیالیزی) و هزینههای بالای اقتصادی آن ، آزمایشهای غربالگری جدید به شدت انجام میشود تا تشخیص آزمایشگاهی زودرس و غیرتهاجمی این بیماری در كودكان انجام شود. یک جایگزین جالب برای خون، که معمولاً در تشخیص استفاده می شود ، بزاق است – بیرون زدگی غدد بزرگ بزاقی (پاروتید ، زیر مندیبول و زیر زبانی) و همچنین تعداد زیادی غده کوچکتر که در مخاط دهان قرار دارند. CKD باعث اختلال در سیستمهای آنتیاکسیدانی آنزیمی و غیر آنزیمی و همچنین افزایش آسیب اکسیداتیو پروتئینهای بزاق و چربیها میشود. پارامترهای بزاق هموستاز ردوکس ممکن است نشانگرهای زیستی تشخیصی بیماری مزمن کلیه در کودکان باشد.
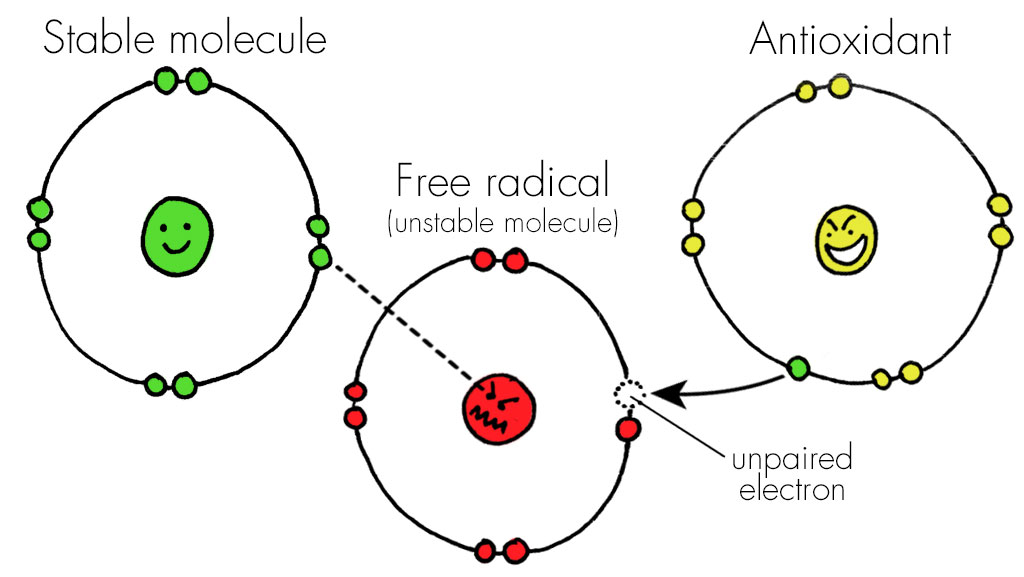
تأثیر قابل توجهی از استرس اکسیداتیو در پاتوژنز بیماریهای مزمن کلیه به طور فزایندهای مورد تأکید قرارگرفتهاست. استرس اکسیداتیو هم با افزایش تولید گونههای اکسیژن فعال (ROS) و هم به دلیل اختلال در مکانیسمهای دفاعی آنتیاکسیدانی ایجاد میشود. فعال شدن سیستم رنین-آنژیوتانسین-آلدوسترون در بیماران مبتلا به CKD باعث اختلال در تولید اکسید نیتریک (NO) شده و فعالیت اکسیداز (NADPH ) را تحریک میکند، که باعث تشکیل رادیکالهای آزاد میشود و ممکن است مسئول فیبروز کلیوی پیشرونده باشد.
مواد شیمیایی موجود در بزاق را می توان به دو گروه تقسیم کرد: ترکیباتی که بطور انحصاری در غدد بزاقی تولید میشوند و آنهایی که از پلاسما به بزاق منتقل میشوند. گروه دوم برای تشخیص آزمایشگاهی از اهمیت ویژهای برخوردار است، زیرا اجزای بیشماری بزاق نشاندهنده غلظت آنها در سرم است. از مزایای استفاده از بزاق در تشخیص آزمایشگاهی همچنین می توان به هزینه کم، سهولت و غیر تهاجمی بودن جمعآوری نمونه و همچنین ماندگاری نسبتاً طولانی بزاق در مقایسه با خون اشاره کرد. بنابراین، بزاق برای تشخیص سرطان و همچنین بیماریهای قلبی عروقی، خود ایمنی، عفونی و متابولیک و در نظارت بر غلظت داروها و یا مسمومیتها استفاده میشود.
در کودکان مبتلا به CKD تشدید مکانیسم های بزاق محافظت از آنتیاکسیدانها (↑ Px ، ↑ SOD ، ↑ GR ، ↑ UA ، ↑ آلبومین) نشان میدهد واکنش تطبیقی بدن به افزایش تولید ROS, TOS منجر میشود. لازم به ذکر است که فعالیت آنتی اکسیدانی کل جزء ساده آنتی اکسیدانهای فردی نیست. ارزیابی کامل وضعیت آنتی اکسیدان/ اکسیدان اطلاعات بیشتری را در اختیار قرار میدهد زیرا شامل تعامل بین آنتی اکسیدانها و نتیجه فعالیت سیستم بیولوژیکی با هدف خنثی سازی رادیکالهای آزاد است. بنابراین، با وجود کاهش قابل توجه غلظت GSH، تعادل ردوکس در بزاق به نفع فرآیندهای آنتی اکسیدانی (↑ TAC ، ↑ FRAP) جابجا میشود. با این حال، آسیب اکسیداتیو به پروتئین ها (AGE ، AOPP) و چربی ها (MDA) در این شرایط رخ میدهد، که نشان میدهد بدن نمیتواند به طور کامل از آسیب اکسیداتیو جلوگیری کند.
منابع:
Peluso, I. and Raguzzini, A., 2016. Salivary and urinary total antioxidant capacity as biomarkers of oxidative stress in humans. Pathology research international, 2016
Maciejczyk, M., Szulimowska, J., Skutnik, A., Taranta-Janusz, K., Wasilewska, A., Wiśniewska, N. and Zalewska, A., 2018. Salivary biomarkers of oxidative stress in children with chronic kidney disease. Journal of clinical medicine, 7(8), p.209.