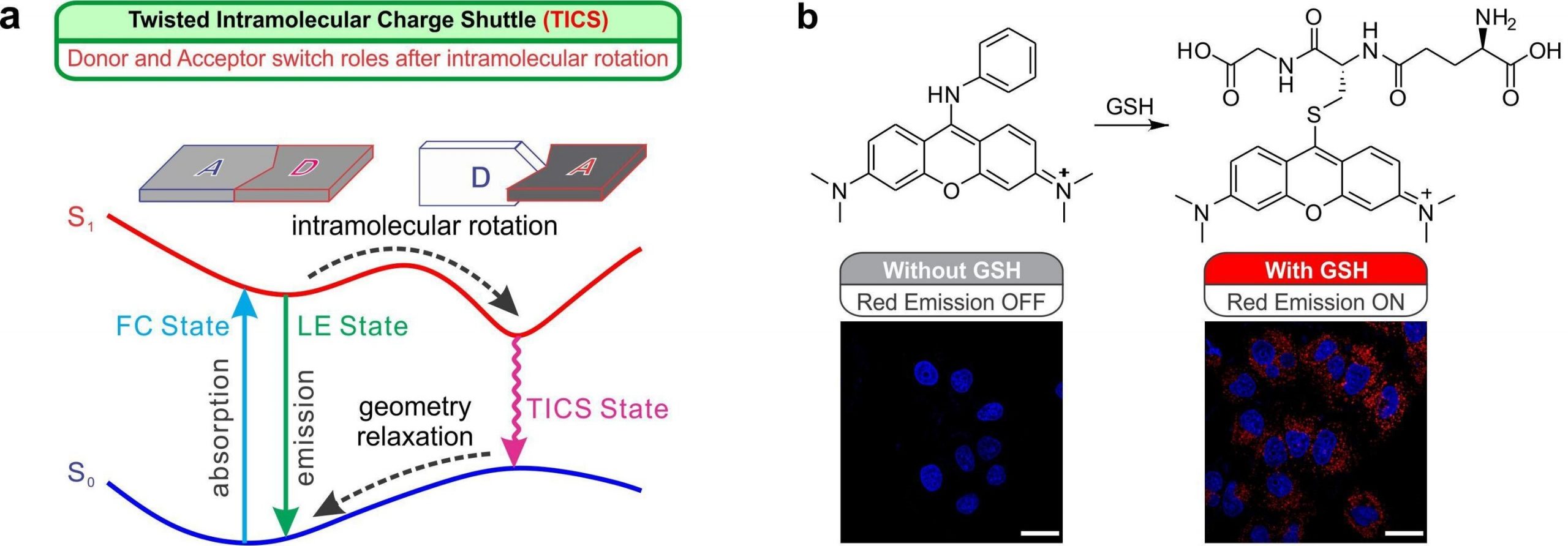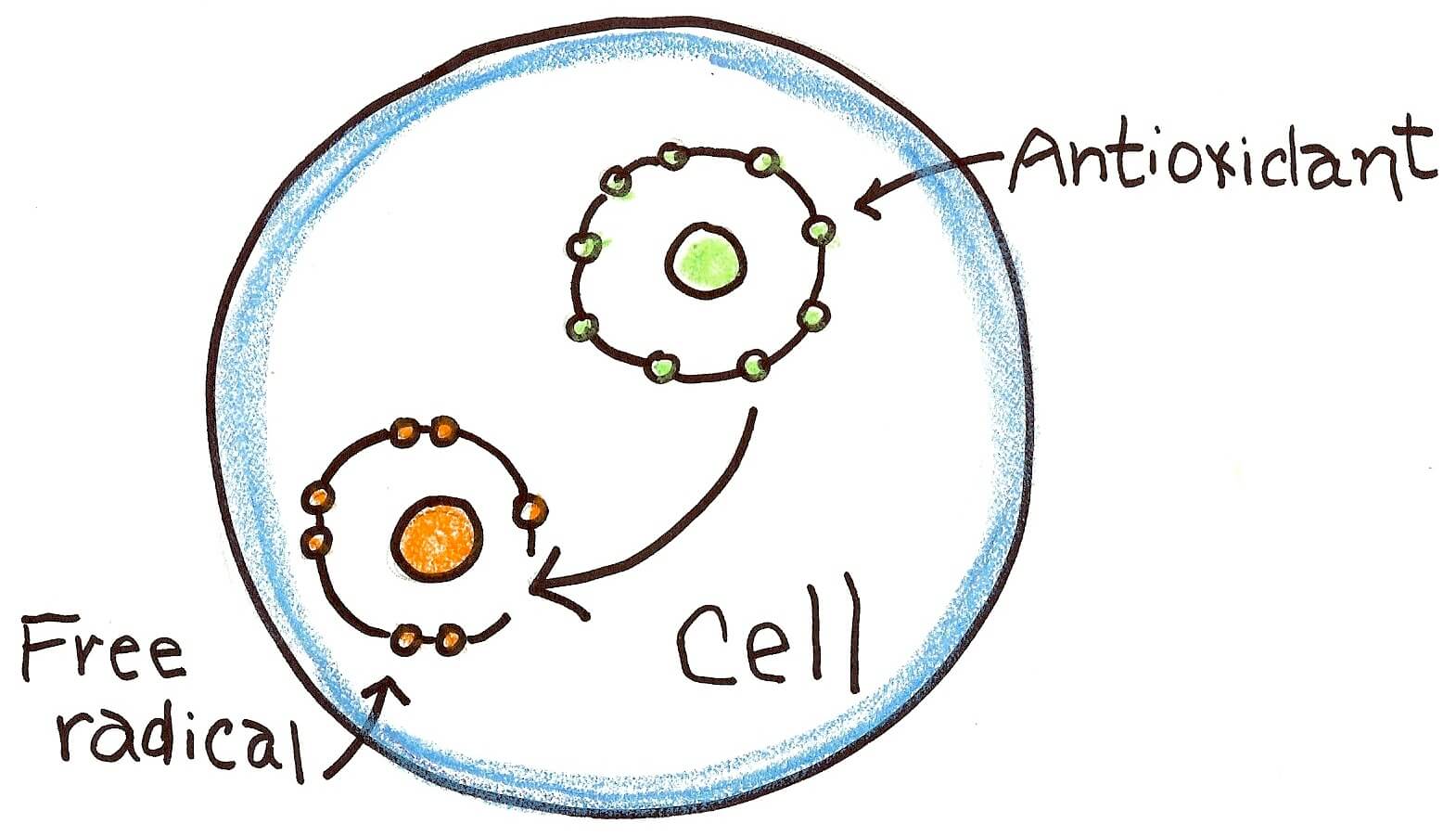
هایپراکسیدهای لیپیدی واسطههای غیر رادیکالی هستند که از اسیدهای چرب غیر اشباع، فسفولیپیدها، گلیکولیپیدها، استرهای کلسترول و کلسترول حاصل میشوند. تولید این واسطهها در واکنشهای آنزیمی و غیرآنزیمی گونههای شیمیایی که از آنها تحت عنوان گونههای فعال اکسیژن (Reactive Oxygen Species) نامبرده میشود، اتفاق میافتد. این گونههای شیمیایی با تخریبی که در بافتهای مختلف ایجاد میکنند، باعث بسیاری از تغییرات سمی در سیستمهای بیولوژیک هستند. گونههای فعال اکسیژن به همراه سایر رادیکالهای هیدروکسیل، لیپید اکسیل یا رادیکالهای پروکسیل، اکسیژن منفرد و پراکسینیتریت حاصل از نیتروژن اکساید تحت عنوان رادیکالهای آزاد نامیده میشوند. این گونههای شیمیایی ماهیت غیرمستقل داشته و یک یا چند الکترون منفرد در اوربیتال اتمی یا مولکولی دارند. آنها به دو روش گرفتن یا دادن الکترون توسط یک غیررادیکال ایجاد میشوند و میتوانند طی واکنشی به نام Homolytic fission یا همکافت ایجاد شوند. طی این واکنش یک پیوند کووالانسی میشکند و هر یک از اتمهای طرفین پیوند یک الکترون منفرد را تصاحب میکنند. واکنش همکافت فعالترین گونههای فعال، یعنی رادیکال هیدروکسیل OH را میسازد. طی واکنش سوختن نیز در دمای بالا با شکستن پیوندهای C-C، C-H و C-O یک پروسه رادیکال آزاد اتفاق میافتد. برعکس این مکانیسم تحت عنوان Heterolytic Fission یا ناهمکافت نام دارد که طی آن پس از شکستن پیوند کووالانسی، یکی از اتمها هر دو الکترون پیوندی را گرفته و دراای بار منفی میشود و در مقابل نیز اتمی با یک اوربیتال خالی دارای بار مثبت میشود.