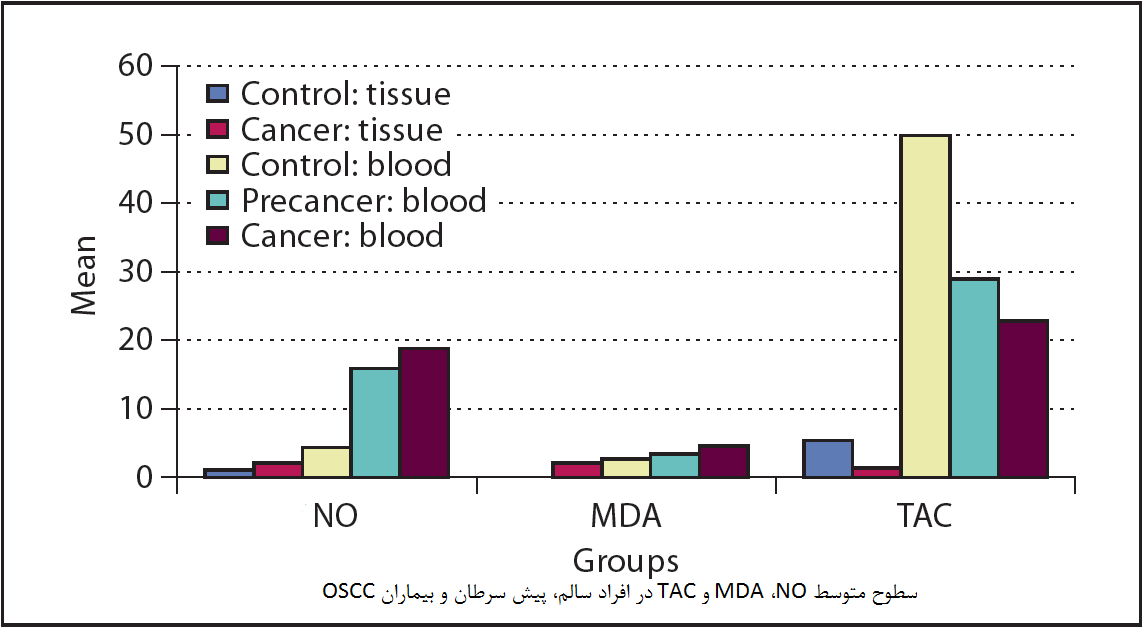
بیماریهای مزمن و استرس اکسیداتیو بیماریهای مزمن یک چالش بزرگ برای پزشکی و زیستشناسی اساسی هستند و مطمئناً برای ده دهه آینده باقی خواهد ماند. به نسبت اپیدمی بیماریهای مزمن مدرن در قسمت دوم قرن بیستم مشاهده شدهاست، فرایندی که هنوز در حال انجام است. در کشورهای در حال توسعه ، این روند بخشی از آنچه به عنوان یک انتقال اپیدمیولوژیک شناخته می شود است ، و به ویژه در قاره آمریکا قابل توجه است. از نظر مشخصه، بیماریهای عفونی به عنوان عامل اصلی مرگ و میر با بیماریهای مزمن یا غیر واگیر جایگزین میشوند. این وضعیت با تغییر رژیم و سبک زندگی همراه است که به پیشرفت بیماریهای مزمن کمک میکند. از جمله رفتارهای خطرناک این انتقال میتوان به مصرف بیش از حد چربی در رژیم غذایی ، مصرف کم میوه و سبزیجات ، سبک زندگی بیتحرک ، استعمال دخانیات و آلودگی محیطی اشاره کرد.
تمرکز اصلی داروهای پیشگیری ، تشخیص و معالجه افراد در معرض خطر است و از ابزارهای مولکولی به طور فزاینده ای برای شناخت خطر استفاده میشود. امروزه بیماریهای مزمن در روابط ژنتیک مولکولی و داروهای پیشگیری قرار دارند. در مورد بیماریهای مزمن مانند بیماری عروق کرونر قلب ، اثرات وابسته به متن تعیینکننده هستند. آنها شامل فعل و انفعالات بین ژنها (معرفت ژنتیکی)و عوامل محیطی (برهم کنش های ژن و محیط) هستند. نکته جالب توجه اینکه، برخی از عوامل خطرزا و شرایط پاتوفیزیولوژیک وجود دارد که بیشتر بیماریها را در گروه بیماریهای مزمن مدرن قرار می دهد: بیماری های قلبی عروقی ، فشار خون بالا ، دیابت و برخی از انواع سرطان. استرس اکسیداتیو یک عامل خطر اصلی در بیماریهای مزمن است.
پلیفنولها در گیاهان متنوعی وجود دارند که به عنوان مؤلفهای مهم رژیمهای غذایی انسان و حیوان مورد استفاده قرار میگیرند. اینها شامل غلات غذایی مانند سورگوم ، ارزن ، جو ، لوبیا خشک ، نخود فرنگی ، نخود کبوتر ، لوبیای بالدار و سایر حبوبات است. میوه هایی مانند سیب ، تمشک ، زغال اخته ، انگور ، هلو ، گلابی ، آلو ، تمشک و توت فرنگی؛ و سبزیجات مانند کلم ، کرفس ، پیاز و جعفری نیز حاوی مقدار زیادی پلی فنول هستند. ترکیبات فنولیک نیز در چای نیز موجود است. رژیم های غذایی حاوی میوه و سبزیجات فراوان در برابر انواع بیماریها ، به ویژه بیماریهای قلبی عروقی و سرطان محافظت میکنند. مواد مغذی اصلی که تصور میشود از میوه و سبزیجات محافظت میکنند آنتی اکسیدانها هستند. پاتر۲۰۰۰ مطالعه اپیدمیولوژیک را مورد بررسی قرار داد ، که اکثر آنها اثر محافظتی از افزایش مصرف میوه و سبزیجات را نشان دادند. هنگامی که نقش آنتی اکسیدان های فردی ، ویتامین های C و E و کاروتنوئیدها توسط مطالعات اپیدمیولوژیک یا آزمایش های مکمل مورد بررسی قرار گرفت، نتایج به اندازه نتایج به دست آمده برای میوه و سبزیجات کاملاً واضح نبود. نتیجه گیری پاتر این بود که میوه و سبزیجات با توجه به اینکه حاوی طیف گسترده ای از اجزای آنتی اکسیدانی مانند پلی فنول ها هستند ، بهترین داروی ضدداروی را در برابر ابتلا به بیماری مزمن ارائه میدهند. رژیمهای غذایی سرشار از میوه و سبزیجات، مانند رژیمهای گیاهی و مدیترانه ای ، حاوی مقدار زیادی پلیفنول هستند. عادتهای غذایی مطابق با محافظت در برابر بیماری عروق کرونر قلب بسیار محدود کننده (در چربیهای اشباع نشده اشباع نشده و یا گیاهخواری) تلقی میشود.
شواهدی وجود دارد که نشان می دهد پلی فنول ها توسط فلور روده متابولیزه می شوند و جذب آنها و متابولیت های آنها می شود. این اطلاعات فعلاً محدود به چند ترکیب است. به طور مشابه ، ما می دانیم که برخی از گونه ها پس از جذب متابولیزه می شوند. میزان ، ویژگی و بومی سازی متابولیسم پلی فنول در ارگانیسم به طور سیستماتیک برقرار نشده است. از این نظر ، ظرفیت شلات سازی شناخته شده پلی فنول ها مسئله مشارکت آنها در جنبه های مربوط به متابولیسم فلزات و آسیب شناسی را مطرح می کند. یکی دیگر از جنبه های متابولیسم پلی فنول به طور سیستماتیک واکنش آن با دیگر آنتی اکسیدانهای بیولوژیکی ست.
یکی دیگر از جنبه های در حال توسعه متابولیسم رادیکال آ زاد، مشارکت آن در فرآیند واسطه و تنظیم عملکرد سلول است. اکسیدنیتریک و آنیون سوپراکسید به طور مداوم در سلولهای هوازی تولید میشوند و عملکرد میتوکندری را تنظیم میکنند. این و سایر رادیکالهای آزاد میتوانند مسیرهای انتقال سیگنال و بیان ژن را تعدیل کنند. بنابراین به نظر میرسد که آنتیاکسیدانهای پلیفنول رژیم غذایی به طور مداوم در تنظیم عملکرد سلولی شرکت کنند.
منبع:
Urquiaga, I.N.E.S. and LEIGHTON, F., 2000. Plant polyphenol antioxidants and oxidative stress. Biological research, 33(2), pp.55-64.