علیرغم اینکه آنتیاکسیدانها در صنعت مکملهای غذایی بسیار درآمدزا میباشند، اما بسیاری از افراد از اطلاعات کافی در مورد آنتیاکسیدانها و فواید آنها برای انسان غافلاند. اعتقاد رایج برایناست که آنتی اکسیدانها قادر به پیشگیری از سرطان بوده و سلولها را در برابر”گونههای فعال اکسیژن” یا “رادیکالهای آزاد” محافظت کنند. رادیکالهای آزاد در سلولها تولید و قادر به تخریب ساختارهای سلولی و ژنوم آن میباشند که نتیجه آن بروز سرطان خواهد بود.
با این حال سلولها انواع مختلفی از سطوح رادیکالهای آزاد را تولید میکنند، مانند برخی سلولهای سیستم ایمنی که برای تخریب پاتوژنها مورد استفاده قرار میگیرند. بنابراین بایستی از مزایا و معایب حذف رادیکالهای آزاد با کمک آنتیاکسیدانها آگاه بود. چنانچه همه رادیکالهای آزاد حذف شوند، ممکن است از اقدامات مفید آنها جلوگیری گردد. دلیل این امر میتواند عدم وجود اطلاعات جامع در مورد نقش آنتی اکسیدانها به عنوان اجازه دهنده یا ممانعت کننده از بروز سرطان و درمان آن بوسیله آنتیاکسیدانها باشد.
محققان در کالج کینگ لندن اخیرا تحقیقاتی در مجله موسسه ملی سرطان منتشر کردهاند که نشان میدهد رادیکالهای آزاد تنها به عنوان عوامل مضر شناخته نمیشوند. مکملهای آنتیاکسیدان میتوانند در برخی موارد آسیب بیشتری در مقایسه با فواید خود در سلولها از خود برجای گذارند.
شکل دادن به سلولهای سرطانی
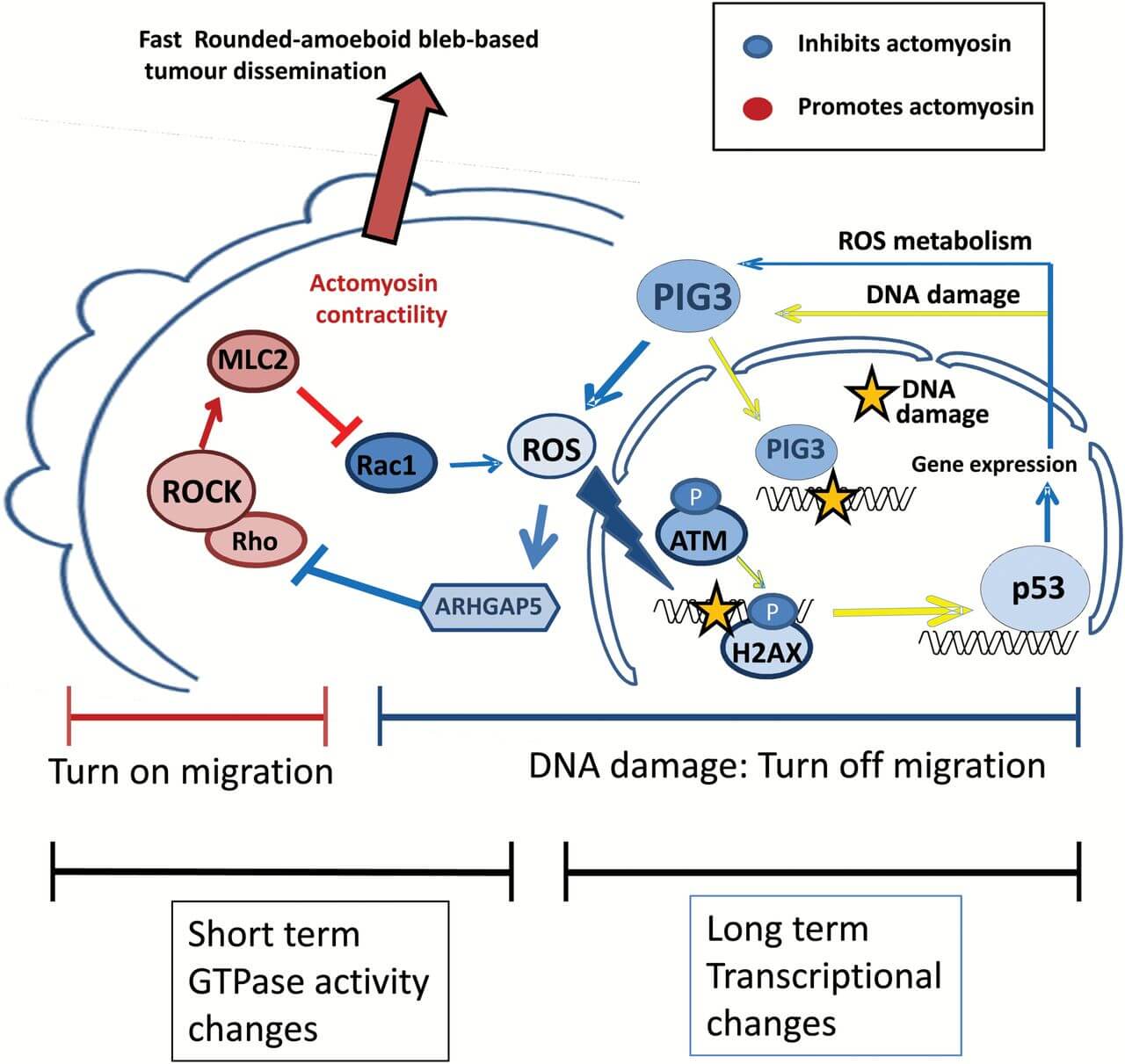
در سال 2008 این مطلب بیان شد که سلولهای ملانوم – جدیترین شکل سرطان پوست – میتوانند شکل خود را بسته به مقدار دو مولکول کلیدی مخالف هم به نامهایRac و Rho که مانند یک سوئیچ عمل میکنند، تغییر دهند. اگر Rac بیشتر و Rho کمتر وجود داشته باشد، سلولها به حالت کشیده Spindly تبدیل میشوند و در حالت عکس سلولها کروی میشوند. به تازگی روشن شده است سلولهای کروی به راحتی قادر به مهاجرت و در نتیجه متاستاز خواهند بود.
به منظور بررسی اینکه چگونه Rac و Rho در مسیر تاثیر رادیکالهای آزاد بر سرطان دخالت دارند، سلولهای ملانوم در آزمایشگاه رشد داده و با استفاده از آنتیاکسیدانها برای حذف گونههای فعال اکسیژن تیمار شدند. در نتیجه سلولها شکل کروی به خود گرفته ، سریعتر مهاجرت کرده و باعث گسترش سریع تودههای سرطانی در سطح بدن شدند.
مهار سیگنالهای Rho و افزایش Rac ، مقدار رادیکالهای آزاد را افزایش و درنتیجه سلول ها را کشیدهتر و حرکت آنها را کندتر میسازد. از سوی دیگر افزایش رادیکالهای آزاد، موجب بیان برخی ژنهای سلولی مانند p53 میشود که موجب محافظت سلول در مقابل سرطان میگردد،لکن در خود سلول در طول سرطان این اثر از بین میرود. ژن دیگر PIG3 است که به ترمیم DNA کمک و به طور غیرمنتظرهای منجربه سرکوب فعالیت Rho میشود.
این مطالعه با بررسی تومورهای پوستی موش تایید شد. اگر سلولهای سرطانی سطوح بالاتری از PIG3 داشته باشند، به علت افزایش رادیکالهای آزاد، حیوانات زندهمانی بیشتری دارند. این تومورها به آرامی رشد میکنند و سلولهای سرطانی به اندازه زیاد گسترش نمییابند.
در مقابل، بیماران انسانی که سطوح پایین PIG3 داشتند، سلولهای سرطانی کروی بیشتری دارا بودند و سریعا در سطح بدن گسترش یافتند. در عین حال، پروندههای ژنتیکی بیماران سرطانی نشان داد افرادی که مبتلا به ملانوم گسترش یافتهاند مقادیر کم PIG3، اما سطح بالایی از پروتئینها تحت کنترل Rho را نشان میدهد.
بنابراین، به طور خلاصه، استفاده از داروها برای کاهش Rho و افزایش محصولات Rac باعث افزایش رادیکالهای آزاد و به همین ترتیب PIG3 میشود که باعث کاهش احتمال گسترش سلولهای سرطانی میگردد. شواهد بدست آمده از این مطالعه قویا این فرضیه را که استفاده از آنتیاکسیدانها قادر به مهار و درمان ملانوما میباشد را رد کرد.
احتیاط مصرف آنتیاکسیدانها
از آنجائیکه اکثر تحقیقات برروی سلولهای ملانوم در محیطهای آزمایشگاهی انجام شده است نتیجه گیری قطعی مستلزم مطالعات بیشتری مبنی بر نقش داروهای مهار کننده مسیر سیگنالینگ Rho بر روی سلولهای سرطانی میباشد. از سویی دیگر داروهای مشابهی در تحقیقات بالینی برای گلوکوم، فشارخون بالا و بیماریهای قلبی مورد آزمایش قرارگرفته و ایمنی مصرف آنها در بیماران تایید شده است. تحقیقات رو به رشد نشان میدهد این خانواده از داروها میتواند به کاهش سرعت گسترش سرطان پوست کمک کند.
مطالعات دیگر نشان میدهد که آنتیاکسیدانها میتوانند خطر ابتلا به سرطان را بالا ببرند و سرعت پیشرفت آنرا افزایش دهند. دوزهای بالایی از آنتیاکسیدانها همچنین میتوانند در برخی از درمانهای سرطانی مانند شیمیدرمانی دخالت داشته باشند که بر رادیکالهای آزاد تأثیر میگذارند و در نهایت باعث کشتن سلولهای سرطانی میشوند.
در حالی که نتایج به طور قطع از آسیبهای آنتیاکسیدانها به سلولهای سالم عاجز هستند اما استفاده از آنتیاکسیدانها در بیماران مبتلا به سرطان از توجه ویژهای برخوردار است. آگاهی کامل از مزایا و معایب مصرف مکملهای آنتیاکسیدانی، مستلزم مطالعات تکمیلی برای ارائه راهکاری جهت مهار رادیکالهای “بد” و تفکیک آنها از رادیکالهای “خوب” میباشد.
: منبع
Herraiz, C., Calvo, F., Pandya, P., Cantelli, G., Rodriguez-Hernandez, I., Orgaz, J.L., Kang, N., Chu, T., Sahai, E. and Sanz-Moreno, V., 2016. Reactivation of p53 by a cytoskeletal sensor to control the balance between DNA damage and tumor dissemination. JNCI: Journal of the National Cancer Institute, 108.1.