مقالات اخیر درباره حملات میگرنی اطلاعات جالبی را ارائه داده است؛ حملات میگرنی مکانیسمی یکپارچه هستند که توسط آن مغز از خود محافظت و ترمیم میکند. میگرن تقریباً ۱۴٪ از جمعیت جهان یا ۱.۰۴ میلیارد نفر را تحت تأثیر قرار دادهاست. تحقیقات نشان میدهد افرادی که میگرن را تجربه میکنند، سطح استرس اکسیداتیو بالاتری دارند.
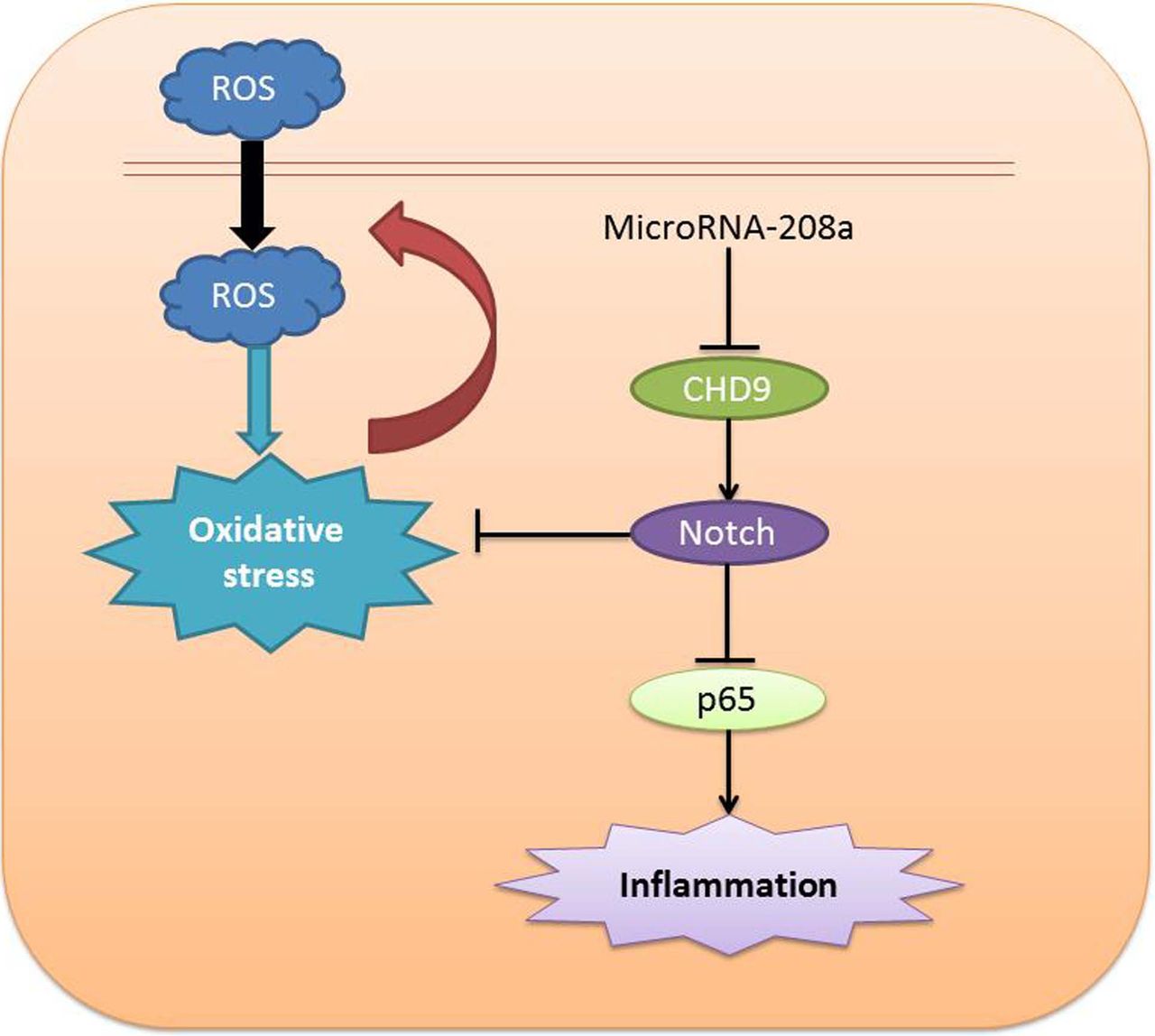
جاناتان بورکوم، دکترا از دانشگاه ماین، بر این باور است که محرکهای میگرنی – از جمله استرس، اختلال در خواب، سر و صدا، آلودگی هوا و رژیم غذایی – میتوانند استرساکسیداتیو مغز را افزایش دهند، که یک عدم تعادل بین تولید رادیکالهای آزاد و توانایی بدن در مقابله با اثرات مضر آنهاست. دکتر بورکوم گفت: “استرس اکسیداتیو یک سیگنال مفید از آسیب قریب الوقوع است زیرا تعدادی از شرایط نامطلوب در مغز می تواند باعث بروز آن شود.” بنابراین ، هدف قرار دادن استرس اکسیداتیو ممکن است به جلوگیری یا پیشگیری از میگرن کمک کند. وی در مقالهای، به طور جداگانه به مؤلفههای حمله میگرن میپردازد. در زمینه تهدید شناختهشده برای مغز- قطع جریان خون- هر یک از مؤلفهها محافظ هستند: تقویت دفاعی آنتیاکسیدانی، کاهش تولید اکسیدان، کاهش نیازهای انرژی و به ویژه آزادکردن فاکتورهای رشد در مغز که از موجود محافظت میکند و از تولد و پیشرفت نورونهای جدید پشتیبانی میکنند. دکتر Borkum توضیح داد: “بین این مؤلفههای حمله میگرنی حلقههای بازخورد وجود دارد که آنها را به یک سیستم یکپارچه وصل میکند.” “بنابراین ، به نظر می رسد که حملات میگرنی به سادگی توسط استرس اکسیداتیو تحریک نمیشود، آنها بهطور فعال مغز را از آن محافظت و ترمیم میکنند.”
سالهاست که حمله میگرن ـدرد، حالت تهوع و حساسیت به نور و صداـ به عنوان یک اختلال مشاهده شدهاست. با اینحال، معمولاً علائم یک بیماری (مانند تب، تورم، درد یا سرفه) خود بیماری نیست بلکه بخشی از دفاع بدن در برابر آن است. دکتر بوركوم گفت: این تئوری در اینجا به ما میگوید كه برای حل میگرن واقعاً باید آسیب پذیری اساسی مغز را بدانیم، یعنی آنچه باعث استرس اکسیداتیو میشود. این تئوری مسیرهای جدیدی را برای یافتن داروهای پیشگیری و شیوه زندگی پیشنهاد میکند، مواردی که بر کاهش استرس اکسیداتیو و افزایش رهایی فاکتورهای رشد متمرکز شدهاند. همچنین نورپردازی در خانهداری، یا اینکه مغز چگونه خود را حفظ و بهبود بخشد، تأثیر میگذارد. دکتربوکروم گفت: “وجود یک سیستم یکپارچه برای محافظت و ترمیم مغز میتواند بسیار مفید باشد، برای مثال، ممکن است روزی بتوانیم از این مکانیسم یاد بگیریم که چگونه از بیماریهای عصبی جلوگیری کنیم.”
منبع:
Medical Science News,Oct 2017,Migraine attacks may actively protect and repair the brain from oxidative stress.