چند سال پیش، دانشمندان در سوئد، بحثهای داغی را در هنگام انتشار تحقیقات نشان دادند که مصرف مکملهای آنتی اکسیدانی مانند ویتامین E باعث میشود که سرطان بیشتر تهاجمی باشد. آنها به این باور رسیدند که آنتی اکسیدانها می توانند به مبارزه با سرطان کمک کنند. در حال حاضر، دو مطالعه مستقل سلولی، یکی از ایالات متحده و دیگری از سوئد، نشان میدهد که چگونه سلولهای سرطانی ریه میتوانند از آنتی اکسیدان ها استفاده کنند تا به گسترش آنها در سایر قسمتهای بدن کمک کند.محققان پیش بینی می کنند که این یافته ها به درمان های جدید برای سرطان ریه منجر خواهد شد که باعث می شود افراد بیشتری در دنیا از سرطان جان سالم به در برند.
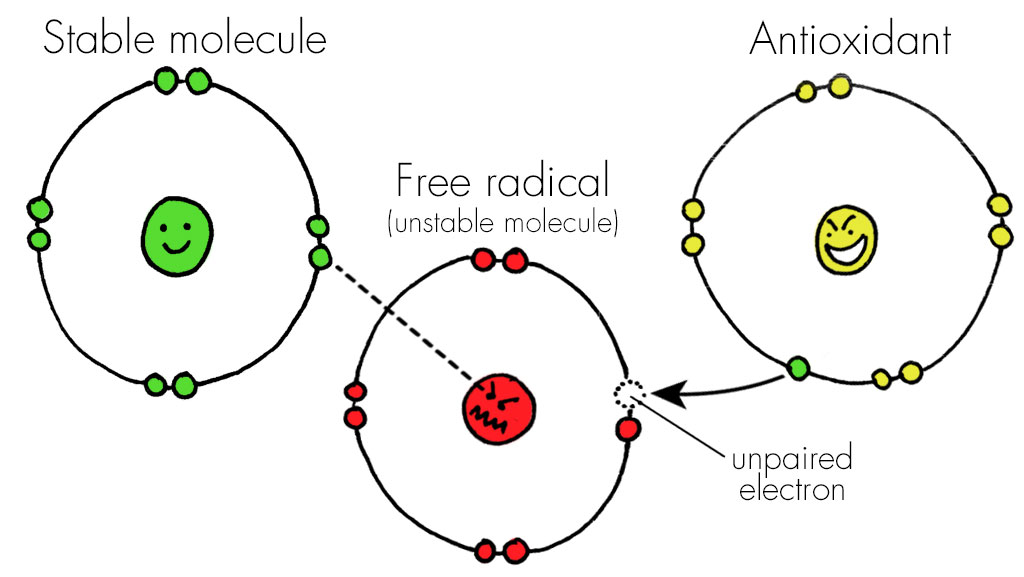
سلول های سرطانی به مقدار زیاد قند یا گلوکز نیاز دارند تا به سرعت رشد کنند و متاستاز شوند و یا گسترش پیدا کنند. برای پاسخگویی به این نیاز، آنها از یک فرایند تولید انرژی استفاده میکنند که سریعتر از آن است که سلول های غیر سرطانی استفاده می کنند. مکانیسم انرژی سریع تر این است که مولکول های زیادی را به نام رادیکالهای آزاد اکسیژن تولید میکند که فشارهای شیمیایی قابل توجهی روی سلولها ایجاد میکند. متاستاز دلیل اصلی این است که سرطان چنین بیماری جدی است. بدون متاستاز، افراد قابل توجه کمتری از سرطان می میرند.
مطالعات جدید که محققان با استفاده از بافت موش و انسان انجام دادند، نشان می دهد که چگونه سلولهای سرطانی ریه از آنتی اکسیدانها برای مقاومت در برابر استرس اکسیداتیو و رشد استفاده می کنند. طبق تحقیقاتی در ایالات متحده چگونگی کمک دو جهش ژنتیکی به سلول های سرطانی ریه، برای غلبه بر استرس اکسیداتیو و ایجاد متاستاز توسط آنتی اکسیدانهای خود اثبات شده است. جهش به تولید آنتی اکسیدان کمک می کند. همچنین مطالعه سوئدی نشان میدهد سلولهای سرطانی ریه از آنتی اکسیدانهای رژیم غذایی برای رسیدن به نتایج مشابه استفاده میکنند آنتی اکسیدانها مکانیسمهای متاستاز را تقویت میکنند.
به نظر می رسد که کاهش استرس اکسیداتیو از طریق آنتی اکسیدانها می تواند ثبات BACH1 را افزایش داده و انباشت آن را در سلول های سرطانی ریه افزایش دهد.(تاثیر کاهش استرس اکسیداتیو بر روی پروتئین به نام Domain BTB و همولوگ 1 (CAC (BACH1 میباشد). BACH1 می تواند مکانیسم هایی را ایجاد کند که متاستاز را تقویت می کنند، یکی از آنها باعث می شود که سلول های سرطانی از گلوکز خون دریافت کنند و آن را به سوخت تبدیل کنند.
سرطان ریه سرطانی است که در سلولهای ریه آغاز می شود. این همان سرطان نیست که در جای دیگر شروع می شود و سپس به ریه ها می رود تا تومورهای ثانویه یا متاستاز های ثانویه ایجاد کند. هنگامی که سرطان که در ریه ها شروع می شود، متاستاز می شود، از طریق گره های لنفاوی به مغز و سایر قسمت های بدن گسترش می یابد.
مطالعات قبلی نشان داده است که حدود 30٪ از سرطان های ریه غیر سلولی شکوفا می شوند، زیرا سلول های آنها یکی از دو نوع جهش را به وجود آورده اند که باعث تولید آنتی اکسیدانی می شود. مطالعه جدید ایالات متحده این جهش ها را بررسی کرد:
۱. یکی از دو جهش که تیم تحقیقاتی ایالات متحده انجام داد، سطح پروتئینی به نام NRF2 را افزایش می دهد که بر روی ژن هایی که سلول های سرطانی ریه را ایجاد می کنند، آنتی اکسیدان ها را ایجاد می کند.
۲. جهش دیگر که تیم تحقیقاتی ایالات متحده تحقیق کرد، KEAP1 را که پروتئینی است که باعث تخریب NRF2 می شود، سوئیچ می کند.
مارتین برگو، نویسنده ارشد مطالعات سوئدی جدید، می گوید: “ما در حال حاضر اطلاعات جدید مهمی در زمینه متاستاز سرطان ریه داریم.” این امکان را برای ما فراهم می کند تا درمان های جدیدی را ایجاد کنیم، مانند آنهایی که مبتنی بر مهار BACH1 هستند. ”
Bergo استاد علوم و علوم تغذیه در موسسه Karolinska در Solna، سوئد است. او تیم را در پشت مطالعات اصلی 2014 هدایت کرد که نشان داد که مکمل های آنتی اکسیدانی در رژیم غذایی، مانند ویتامین E، می تواند رشد تومور را تشدید کند.
او می گوید که یافته های جدیدشان “نشان می دهد که متاستاز تهاجمی ناشی از آنتی اکسیدان ها می تواند با متوقف ساختن BACH1 یا با استفاده از داروهایی که سرکوب شکر را متوقف می کنند، مسدود شود.” او اضافه می کند “همکاران آمریکایی ما” نشان می دهند که چگونه مهار کننده آنزیم دیگری، heme oxygenase که با BACH1 مرتبط است، می تواند فرآیند متاستاز را مهار کند. ”
محققان همچنین معتقدند که یافته ها نشان می دهد بینش های جدید در مورد مکانیسم سریع تر که سلول های سرطانی برای تولید انرژی استفاده می کنند، که دانشمندان به اثر Warburg اشاره می کنند: “برای بیماران مبتلا به سرطان ریه، مصرف ویتامین E ممکن است افزایش قابل توجهی در توانایی سرطان را به عنوان جهشهای NRF2 و KEAP1 افزایش دهد.”