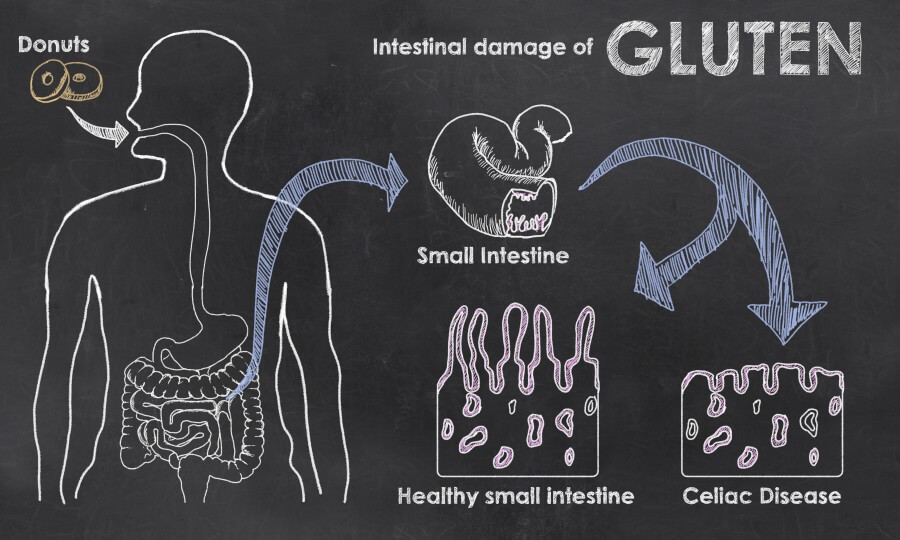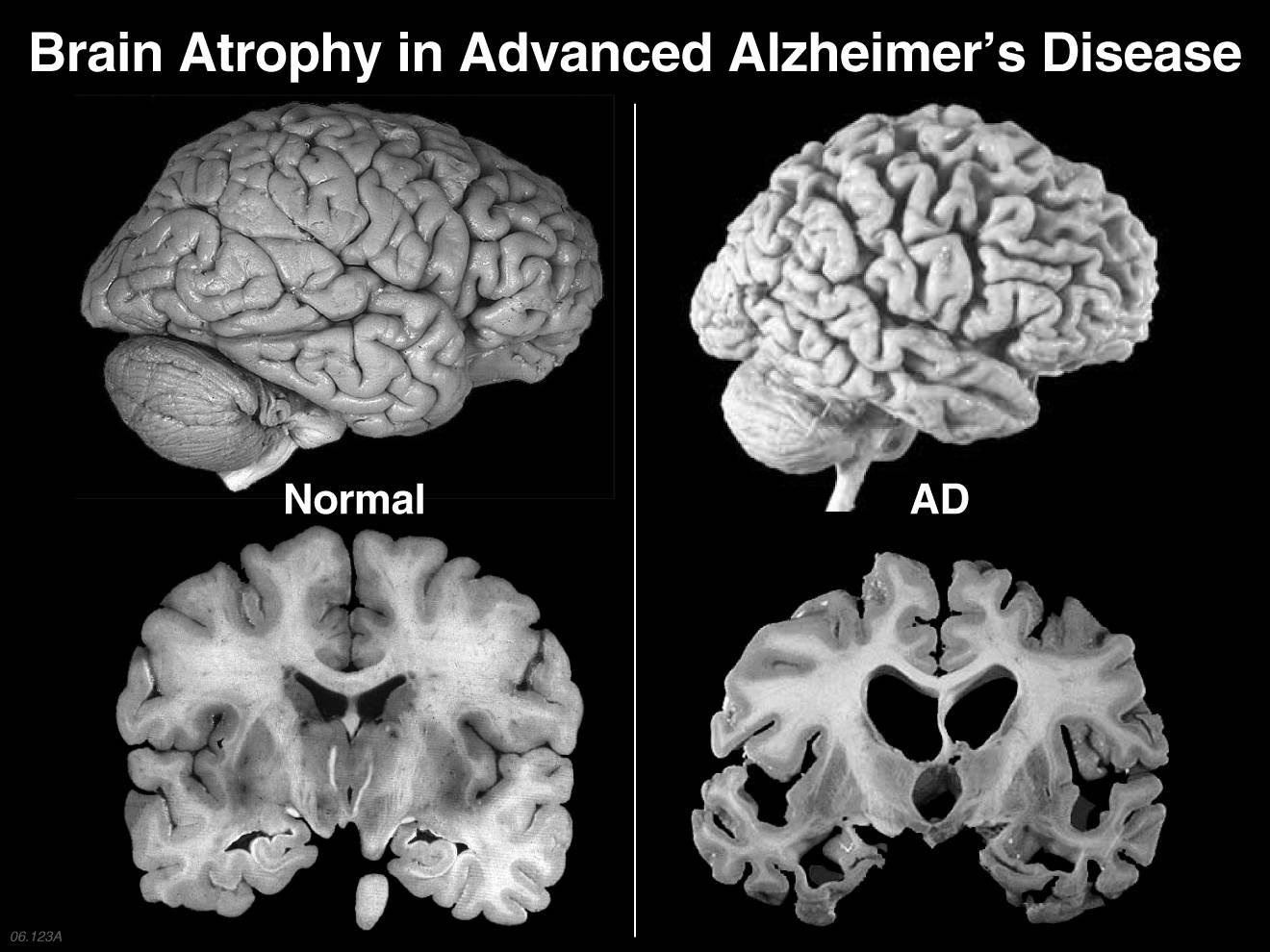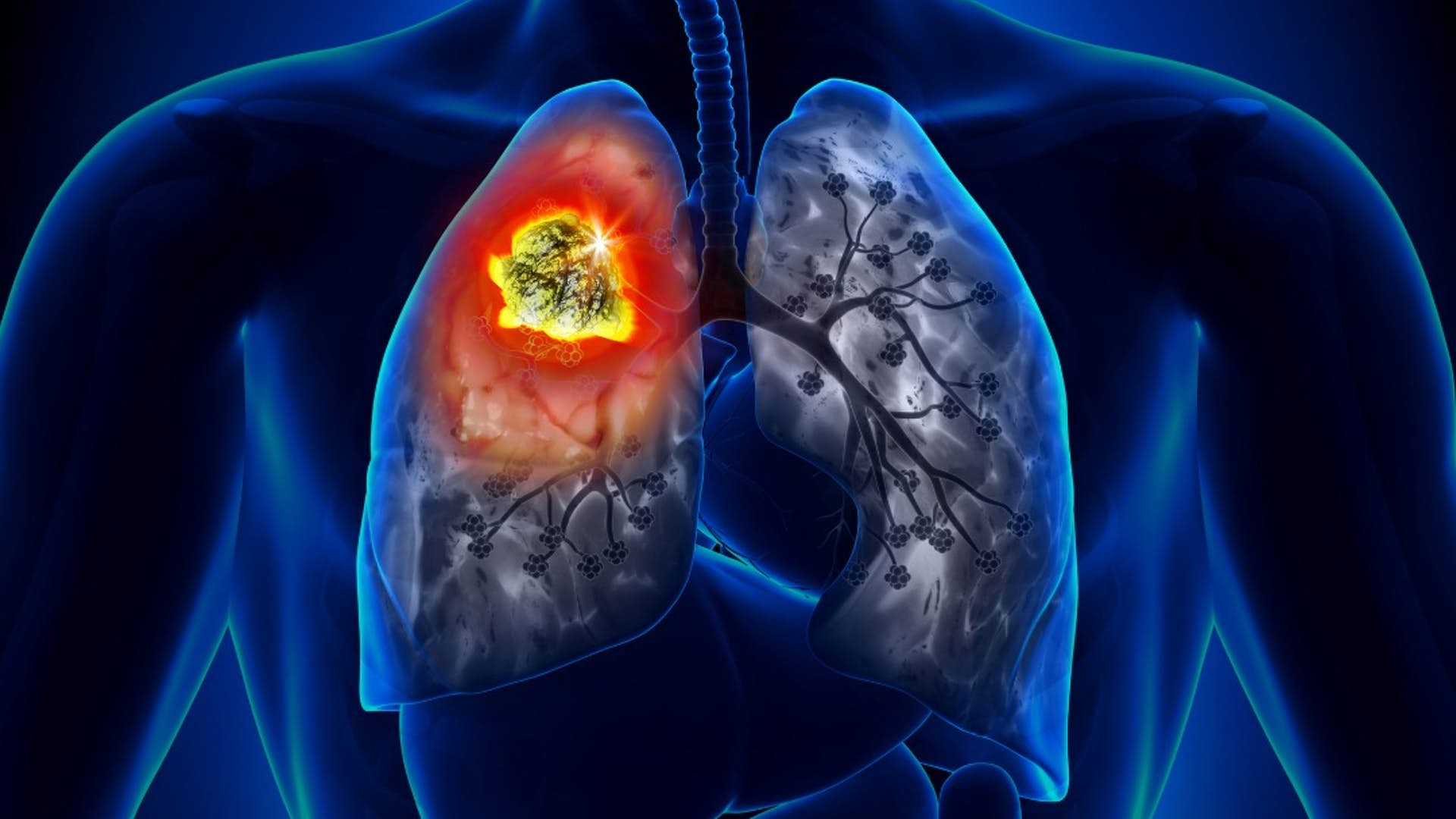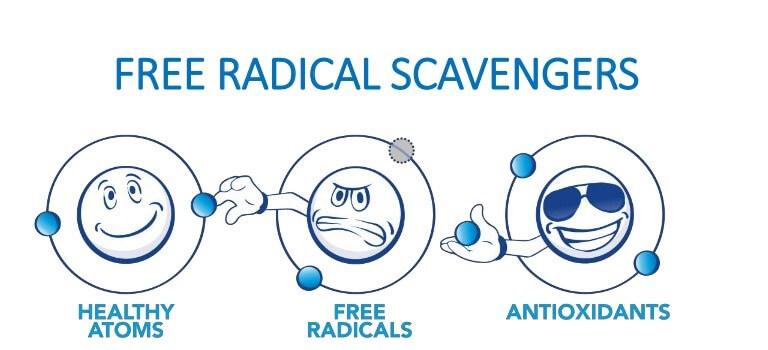
رادیکالهای آزاد اتمها یا مولکولهایی با الکترون آزاد هستند که بسیار ناپایدار و واکنش پذیر میباشند. این ذرات با مولکولهای دیگر در بدن واکنش داده و باعث تغییر ساختار مولکولی میگردند. این مولکولها تبدیل به رادیکالهای آزاد شده که یک واکنش زنجیرهای را ایجاد میکنند که میلیونها مولکول را در یک نانوثانیه تحت تاثیر قرار میدهند. رادیکالهای آزاد با عنوان گونهفعالاکسیژن بیانشده (ROS)، بنابراین استرس رادیکال آزاد به عنوان استرس اکسیداتیو شناخته میشود. علل بسیاری جهت بروز استرس اکسیداتیو وجود دارد که به عنوان مکانیسم اصلی در بیماریهای مزمن و پیری شناخته میشود.
آنتیاکسیدانها
آنتیاکسیدانها مکانیسم دفاعی بدن علیه رادیکالهای آزاد هستند که این ذرات آسیب پذیر را خنثی میکنند. برخی از رادیکالهای آزاد به عنوان بخش مهمی از فرایندهای بدن تولید میشوند، اما نباید تولید رادیکالهای آزاد از ظرفیت بدن در خنثیسازی آن فراتر رود.
آنتیاکسیدانهای داخلی بدن عبارتند از: گلوتاتیون، کوآنزیم Q10، سوپراکسید دیسموتاز و گلوتاتیون پراکسید
عوامل بیرونی ایجاد رادیکالهای آزاد عبارتند از:
• نگهدارندهها و مواد شیمیایی در غذاها
• آفتکشها در غذاهای غیر آلی
• داروهای تجویزی
• آلودگی و تابش و آفتاب سوختگی
• فلزات سنگین مانند جیوه، آلومینیوم و سرب
• الکل و سیگار
• ترانس و چربیهای هیدروژنه شده
عوامل درونی ایجاد رادیکالهای آزاد عبارتند از:
سیستم ایمنی بدن رادیکالهای آزاد را در جهت از بین بردن باکتریها، ویروسها و قارچها تولید میکند. اگر سیستم ایمنی بدن بیش از حد فعال باشد (در موارد التهاب مزمن)، بار اضافی از استرس اکسیداتیو در بدن ایجاد میشود. در شرایط خاصی که عملکرد سیستم ایمنی بدن کاهش مییابد، عفونت های مزمن و بیماری مزمن متنوعی در بدن ایجاد میشود.
بدن به طور طبیعی رادیکالهای آزاد را به عنوان یک محصول جانبی از تولید انرژی سلولی و سمزدایی از کبد تولید میکند. استرس به طور قابل توجهی باعث افزایش بار رادیکال آزاد در بدن میشود. همانطور که استرس موجب ترشح هورمونها میشود، بدن آمادگی لازم جهت مبارزه و پاسخ ایمنی را به دست میآورد که باعث ایجاد تغییرات زیست شیمیایی و افزایش استرس اکسیداتیو در بدن میگردد.
منابع:
Halliwell, B. and Gutteridge, J.M., 1990. [1] Role of free radicals and catalytic metal ions in human disease: an overview. Methods in enzymology, 186, pp.1-85.
Halliwell, B., 1994. Free radicals, antioxidants, and human disease: curiosity, cause, or consequence?. The lancet, 344(8924), pp.721-724.
Valko, M., Leibfritz, D., Moncol, J., Cronin, M.T., Mazur, M. and Telser, J., 2007. Free radicals and antioxidants in normal physiological functions and human disease. The international journal of biochemistry & cell biology, 39(1), pp.44-84.