ترمیم زخم متشکل از پروسهها و واکنشهای بسیار زیادی است. بهصورت کلاسیک ترمیم زخم به ۴ فاز تقسیم میشود:
۱. فاز هوموستاز
۲. فاز التهابی
۳. فاز پرولیفراسیون
۴. فاز بلوغ و Remodeling
با وجود این دستهبندی، این فازها کاملا جدا از هم نیستند و بعضا همپوشانی در آنها دیده میشود. بلافاصله بعد از هر آسیب، پلاکتها شروع به تجمع کرده، پلاکها را تشکیل میدهند و در عروق آسیبدیده مانع از خونریزی میشوند. همزمان، پروسههای التهابی شروع میشوند و طیفی از سلولهای التهابی به محل ضایعه جذب میشوند.
درحالی که این سلولهای ایمنی سایتوکاینهای پیشالتهابی ترشح میکنند، سلولهای التهابی (بهویژه نوتروفیلها) مقادیر زیادی گونههای فعال اکسیژن (ROS) تولید میکنند. این مواد برای حفاظت بدن در مقابل یک عفونت ضروری هستند اما در صورت تولید بیش از حد میتوانند به بافتهای اطراف صدمه بزنند. در پروسه عادی ترمیم زخم، سایتوکاینهای التهابی و سلولهای ایمنی طی چند روز پس از آسیب کاهش مییابند. درست در این زمان، کراتنوسیتها، فیبروبلاستها و سلولهای اندوتلیال شروع به ترشح فاکتورهای رشد متعدد میکنند.

در فاز پرولیفراتیو، بههمراه بازسازی اپیتلیال و رگزایی (آنژیوژنز)، سنتز کلاژن و ترکیب ماتریکس انجام گرفته و باعث تولید بافت گرانوله میشود. سلولهای اپیتلیال بهصورت افقی حرکت میکنند تا به همتایان خود از طرف مقابل برسند. فیبروبلاستها از لبههای زخم فراخوانده میشوند تقسیم شده و باعث تحریک کراتینوسیتها به مهاجرت و تقسیم میشوند. رگزایی جدید (Neovascularization) اتفاق میافتد و شروع به تغذیه و اکسیژنرسانی بافت در حال اتصال میکند. سپس فیبروبلاستهای تقسیم شده پروتئینهای ماتریکس از جمله کلاژن را برای ساخت ماتریکس خارج سلولی (ECM) ترشح میکنند، که در مجموع باعث ساخت بافت پیوندی میشود.
هدف در این مطلب تشریح نحوه ترمیم زخم نیست و صرفا جهت مقدمه و آمادهسازی موضوع مطالب ذکر شد. اکنون به نقش مهم آنزیم آنتی اکسیدانتی سوپراکسید دیسموتاز در این مورد میپردازیم.
سوپراکسید دیسموتاز و نقش آن در ترمیم زخم
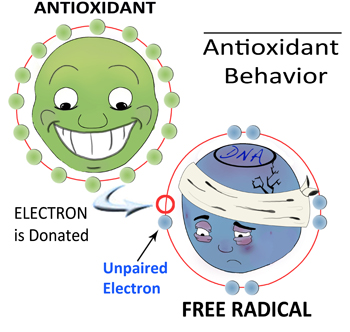
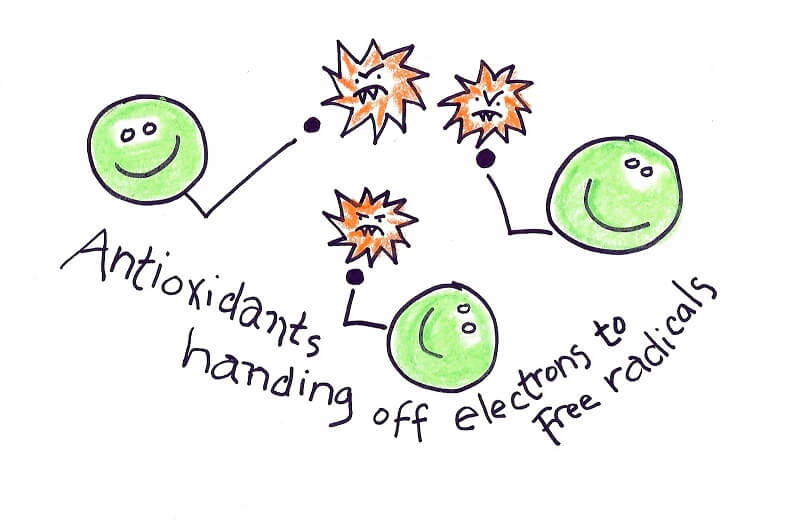
آنیونهای سوپراکسید ROSهای اولیهای هستند که از اکسیژن مولکولی بهوجود میآیند. اگر نیتریک اکساید (NO) که در اثر فعالیت آنزیم نیتریک اکساید سنتاز تولید میشود، در محیط موجود باشد، آنیونهای سوپراکسید با آن واکنش داده و پراُکسی نیتریتها را تولید میکنند. پراکسی نیتریت مادهای برای از بین بردن باکتری و حفظ محیط زخم از عفونت است، اما در عین حال مادهای سمی و بسیار اکسیدکننده نیز هست. برای جلوگیری از واکنشهای آسیبرسان، آنیونهای سوپراکسید اضافی تولید شده توسط آنزیم سوپراکسید دیسموتاز یا SOD بهسرعت به H2O2 تبدیل میشوند. خانواده آنزیم سوپراکسید دیسموتاز ۳ عضو دارد: SOD1 که در سیتوپلاسم و فضای بینغشایی میتوکندری موجود است. SOD2 که در ماتریکس میتوکندری وجود دارد و SOD3 که در فضای خارج سلولی موجود است و اولین خط دفاعی در مقابل استرس اکسیداتیو در فضای خارج سلول را تشکیل میدهد.

از آنجایی که پوست بهنسبت سایر بافتها بیشتر در معرض سمیت ناشی از اکسیژن قرار میگیرد، سوپراکسید دیسموتاز نیز در تحقیقات زخم بسیار مورد پرسوجو قرار گرفته است. آنزیمهای SOD1 و SOD2 در سطح RNA در زخمها به مقدار بسیار زیادی تشخیص داده شدهاند. با این وجود فعالیت SOD در هنگام ترمیم زخم در رتها کاهش مییابد. اما ممکن است این سوال پیش آید که آیا فعالیت SOD برای ترمیم زخم لازم است؟ پاسخ این سوال در موشهای فاقد ژن کد کننده SOD1 کمی پیچیده است. در موشهای ۲۰ هفتهای، نبود SOD1 باعث تاخیر در ترمیم میشود اما در موشهای جوانتر (۵-۶ هفته) تفاوتی در زمان ترمیم در گروه فاقد SOD1 گزارش نشده است. شاید این نتایج اهمیت وجود SOD را در ترمیم زخم در پیری بیشتر بارز کند. چرا که گزارش شده است نبود SOD1 در فیبروبلاستهای انسان باعث پیری سلول میشود. همچنین برای نگهداری سلولهای فیبروبلاست جنینی موش (MEFs) نیز وجود SOD1 ضروری است. از این رو موشهای فاقد SOD1 در سمزدایی و خنثی کردن آنیونهای سوپراکسید تولید شده در متابولیسم سلولی، ناتوان هستند. علاوه بر این بافت آسیبدیده زخم در معرض اکسیژن اتمسفریک قرار میگیرد و این مورد با تاثیر بر چرخه ردوکس سلولی بر روند ترمیم تاثیر خواهد گذاشت.
در نهایت، اهمیت آنزیمهای کنترل کننده اکسیدانها بر کسی پوشیده نیست و شما میتوانید در تحقیقات خود نیز برای سنجش سوپراکسید دیسموتاز اقدام کنید
منابع:
-Sun, B.K.; Siprashvili, Z.; Khavari, P.A. Advances in skin grafting and treatment of cutaneous wounds. Science 2014, 346, 941–945.
-Fridovich, I. Superoxide radical and superoxide dismutases. Annu. Rev. Biochem. 1995, 64, 97–112.
-Steiling, H.; Munz, B.; Werner, S.; Brauchle, M. Different types of ROS-scavenging enzymes are expressed during cutaneous wound repair. Exp. Cell Res. 1999, 247, 484–494.
-Shukla, A.; Rasik, A.M.; Patnaik, G.K. Depletion of reduced glutathione, ascorbic acid, vitamin E and antioxidant defence enzymes in a healing cutaneous wound. Free Radic. Res. 1997, 26, 93–101.
-Iuchi, Y.; Roy, D.; Okada, F.; Kibe, N.; Tsunoda, S.; Suzuki, S.; Takahashi, M.; Yokoyama, H.; Yoshitake, J.; Kondo, S.; et al. Spontaneous skin damage and delayed wound healing in SOD1-deficient mice. Mol. Cell. Biochem. 2010, 341, 181–194.
-Tsunoda, S.; Kibe, N.; Kurahashi, T.; Fujii, J. Differential responses of SOD1-deficient mouse embryonic fibroblasts to oxygen concentrations. Arch. Biochem. Biophys. 2013, 537, 5–11.