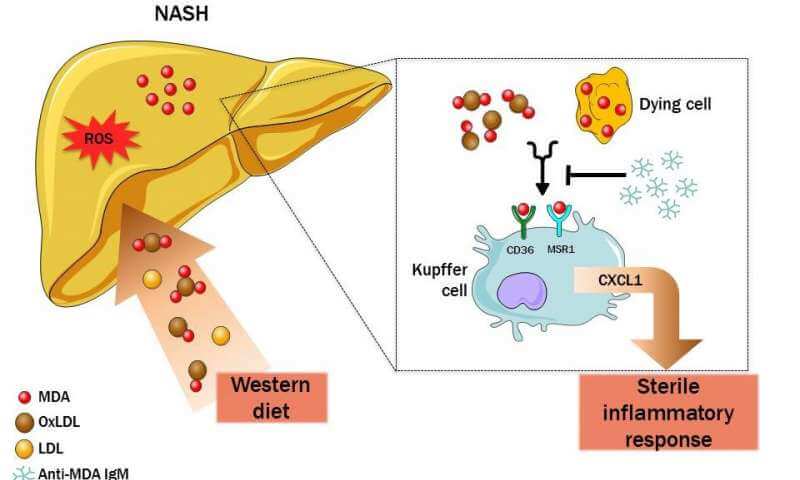
بیماریهای مرتبط با رژیم غذایی مانند كبد چرب غیر الكلی (NAFLD) عامل حاوی تركیبات التهابی شناخته می شوند. با این حال راههای مرتبط با تغییرات القا شده توسط رژیم غذایی ناشناخته باقی ماندهاند. در مطالعهی جدیدی که توسط دانشمندان در مركز تحقیقات پزشكی CeMM اتریش و دانشگاه پزشكی وین انجام داده اند فرایندهای بسیار مهمی در NAFLD شناسایی شده اند. علاوه بر این، تحقیق منتشر شده در مورد كبد نشان داد كه مالوندی آلدهید (MDA) كه بیوماركر استرس اكسیداتیو است نقش مهمی در توسعه كبد چرب دارد و می تواند با آنتی بادیهای طبیعی مخصوصی خنثی شود؛ رویكرد جدیدی كه درمان بالقوه ای برای این بیماری شایع محسوب می شود.
تركیبی از مواد مغذی، رژیم غذایی غربی و عدم تحرك در سبك زندگی می تواند به مسئلهی مهمی در سلامتی انسان تبدیل شود. در سطح جهان چاقی، فشار خون بالا و مقاومت به انسولین به صورت نگران كنندهای بالاست. در نتیجه متعاقبا ریسك گسترش بیماریهای مرتبط با التهاب مانند دیابت نوع ٢، NAFLD و بیماریهای قلبی و عروقی افزایش یافته است. با این حال مسیر دقیق ارتباط بین عادات غذایی و التهابات به طور كامل و واضح درك نشده است.
تیم تحقیقاتی فقط موفق به روشن كردن پروسهی بیولوژیكی كه رشد التهاب مزمن در یك رژیم غذایی مغذی را در موش نشان میدهد نشدند بلكه علاوه بر آن دانشمندان دریافتند كه MDA نقشی كلیدی در التهاب كبدی دارد كه با آنتی بادیهای طبیعی خنثی میشود. مولكول بسیار فعال مالوندی الدهید كه محصول تجزیهی لیپید و بیوماركر استرس اكسیداتیو است بر روی سطح سلولهای در حال مرگ تجمع میكند. از نظر شیمیایی با پروتئینها و لیپیدهای سطح غشا پیوند برقرار می كند و اپی توپهای MDA را تشكیل می دهند. گروه تحقیقاتی بایندر نشان داد كه اپی توپهای MDA ترشح سیتوكنین و همچنین به خدمت گرفتن لوكوسیتها را القا و در نتیجه التهاب موجود را منتشر و به سوی مزمن شدن پیش میبرند.
كلارا جانا نویسندهی اصلی مقاله و یكی از اعضای تیم تحقیقاتی می گوید كه “ما قادر به نشان دادن نقش مهم MAD در التهاب كبدی القا شده با رژیم غذایی در كشت سلولی وحیوانات آزمایشگاهی هستیم”. تیم هنریك همكار دیگر طرح میگوید “این تنها دست آورد این تحقیق نبوده” بلكه آنها توانستند با تزریق وریدی آنتیبادی اختصاصی MDA كه به اپیتوپهای MDA متصل می شود، التهاب را در موشها كاهش ببخشند. نویسندهی مسئول مقاله، كریستوف بایندر می گوید “با استفاده از روشهای برش لبههای توالی RNA و تجزیه و تحلیل دادههای رونویسی مكانیسمهای كلیدی در بیشتر بیماریهای شایع كشف و آنها را در مدلهای آزمایشگاهی تایید كردیم”.
منبع: