محققان ژنهای مرتبط با بقا را در کودکان مبتلا به کلستاز نوزادی شناسایی میکنند.
دانشمندان در مرکز پزشکی بیمارستان کودکان یک الگوی بیانی برای ۱۴ ژن دخیل در طول عمر نوزادان مبتلا به کلستازی نوزادان را شناسایی کردند. این بیماری در کودکان با پیوند کبد بسیار رایج است.
این پژوهشگران همچنین دریافتند که آنتیاکسیدان N استیل سیستئین (NAC) منجر به کاهش آسیب کبدی و فیبروز (بافت پیوندی رشتهای) در موش مبتلا به کلستازی و افزایش زمان بقا میشود.
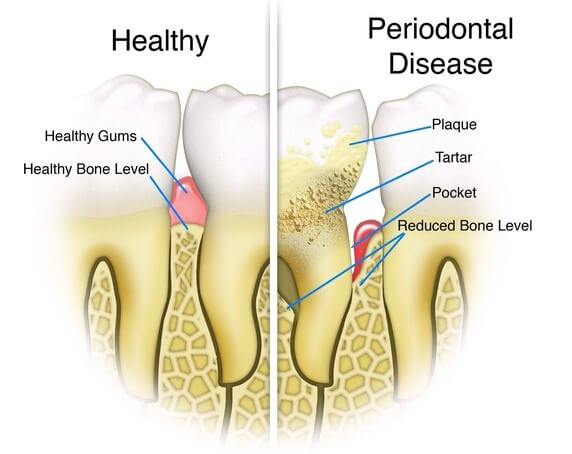
کلستازی نوزادی همچنین به نام extrahepatic ductopenia ، یک بیماری کبدی در کودکان است که در آن یک یا چند مجرای صفرا، به طور غیر طبیعی باریک و یا مسدود میشوند. این بیماری میتواند مادرزادی یا اکتسابی باشد. کلستازی به عنوان یک نقص مادرزادی بیشتر در آسیای شرقی با مقدار 1 در 5000 تولد، رایج است. علائم این بیماری در حدود دو تا هشت هفته پس از زایمان ظاهر میشود. هنگامی که یک کودک مبتلا به کلستازی باشد، جریان صفراوی از کبد به کیسه صفرا مسدود شده و این باعث میشود که صفرا در داخل کبد به دام افتاده و در نهایت باعث نارسایی کبد شود.
در ابتدا، علائم کلستازی مانند علائم زردی نوزادان، یک بیماری معمولی بیضرر که معمولا در نوزادان دیده میشود، قابل تشخیص نیستند. علائم متفاوتی از کلستازی معمولا بین دو تا هشت هفته پس از تولد مشخص میشود. نوزادان و كودكان مبتلا به کلستازی پیشرفته، وضعیتی است كه در آن صفرا نمیتواند كبد را ترک كند و در داخل آن جمع میشود. هنگامی که کبد، بیلیروبین را از طریق مجاری صفراوی به صورت صفرا خارج نمیکند، بیلی روبین شروع به جمع شدن در خون کرده و علایم ایجاد میشوند. این علائم عبارتند از زرد شدن پوست، خارش، جذب کم مواد مغذی (باعث تاخیر در رشد)، مدفوع کمرنگ، ادرار تیره و شکم تحریک شده. این بیماری اگر بدون درمان باقی بماند، ماده صفراوی میتواند منجر به نارسایی کبدی شود. بر خلاف دیگر انواع زردی، کلستاز وابسته به صفراوی آپریزی اغلب باعث کریستال شدن، یک نوع آسیب مغزی ناشی از اختلال عملکرد کبدی میشود. این به این دلیل است که در کلستازی صفراوی، کبد بیمار هنوز قادر به ساخت بیلیروبین است اما قادر به عبور از مانع خون مغزی نیست.
بررسی رابطه بین تاثیر 14 ژن در این بیماری، تشخیص و توسعه درمانهای جدید را فراهم میکند. یک روش بررسی بسیار قوی، طراحی یک آزمایش بالینی برای فعال کردن مسیر گلوتاتیون است. گلوتاتیون مولکولی است که در نوزادان با کلستازی صفراوی بسیار بیان شده است. فعالسازی مسیر، توسط آنتیاکسیدان NAC در جهت بهبود جریان صفراوی و جلوگیری از پیشرفت فیبروز صورت میگیرد.
محققان بیوپسیهای کبدی و دادههای بالینی از نوزادان مبتلا به کلستازی که جریان صفراوی در آنها کاهش یا متوقف شده بود را دریافت کردند. نوزادان در مرکز تحقیقات بیماریهای کبد کودکان مطالعه شدند. بیوپسیهای کبدی در زمان تشخیص بیماری به دست آمده است. دانشمندان NAC را به موشهای نوزاد مبتلا به کلستازی و فیبروز، که بیلیروبین و فیبروز کبدی را کاهش میدهد، تجویز کردند. بیلیروبین یک ماده زرد نارنجی است که در طول تجزیه عادی گلبولهای قرمز ساخته میشود. بیلیروبین از طریق کبد عبور و در نهایت از بدن دفع میشود. با این حال، سطوح بالاتر این ماده میتواند مشکلات کبدی ایجاد کند.
دکتر Bezerra بیان میکند: “ما هنوز نمیدانیم که آیا NAC در نوزادان مبتلا به کلستازی ایمن و موثر است یا خیر. آزمایشات بالینی آینده قطعا تاثیر این ماده را در این بیماری مشخص خواهد کرد.”
منابع:
Bezerra, J.A., Wells, R.G., Mack, C.L., Karpen, S.J., Hoofnagle, J.H., Doo, E. and Sokol, R.J., 2018. Biliary Atresia: Clinical and Research Challenges for the Twenty‐First Century. Hepatology, 68(3), pp.1163-1173.
Berauer, J.P., Mezina, A.I., Okou, D.T., Sabo, A., Muzny, D.M., Gibbs, R.A., Hegde, M.R., Chopra, P., Cutler, D.J., Perlmutter, D.H. and Bull, L.N., 2019. Identification of Polycystic Kidney Disease 1 Like 1 Gene Variants in Children With Biliary Atresia Splenic Malformation Syndrome. Hepatology.
Mack, C.L., Spino, C., Alonso, E.M., Bezerra, J.A., Moore, J., Goodhue, C., Ng, V.L., Karpen, S.J., Venkat, V., Loomes, K.M. and Wang, K., 2019. A Phase I/IIa trial of intravenous immunoglobulin following portoenterostomy in biliary atresia. Journal of pediatric gastroenterology and nutrition, 68(4), pp.495-501.