بیماریهای مرتبط با رژیم غذایی مانند بیماری کبد چرب غیر الکلی (NAFLD)، دارای یک عنصر التهابی عمده هستند. با این حال، مسیرهای مولکولی مرتبط با رژیم غذایی که منجر به التهاب میشوند، ناشناخته است. در یک مطالعه جدید، دانشمندان مرکز تحقیقاتی CeMM دانشکده مولکولی آکادمی علوم اتریش و دانشگاه پزشکی وین، پروسههای التهابی مهمی را در بیماری NAFLD شناسایی کردند. علاوه بر این، مطالعه منتشر شده در Hepatology نشان میدهد که مالوندیآلدهید (MDA) بیومارکر استرس اکسیداتیو، نقش مهمی در بروز NAFLD دارد و میتواند توسط آنتیبادیهای طبیعی خنثی شود که به عنوان یک رویکرد جدید در درمان بالقوه این بیماری شایع معرفی میشود.
ترکیبی از رژیم غذایی غلط و فقدان ورزش میتواند به مشکلات جدی سلامتی منجر شود: در سراسر جهان، موارد چاقی، فشار خون بالا یا مقاومت به انسولین در سطح هشداردهنده قرار دارند. در نتیجه، خطر ابتلا به بیماریهای مرتبط با التهاب مانند دیابت نوع 2، NAFLD و بیماریهای قلبی عروقی بر این اساس افزایش یافته است. با این حال، مسیرهای دقیق که عادات غذایی را با التهاب ناشی از آن پیوند دهند تاکنون به خوبی شناخته نشده است.
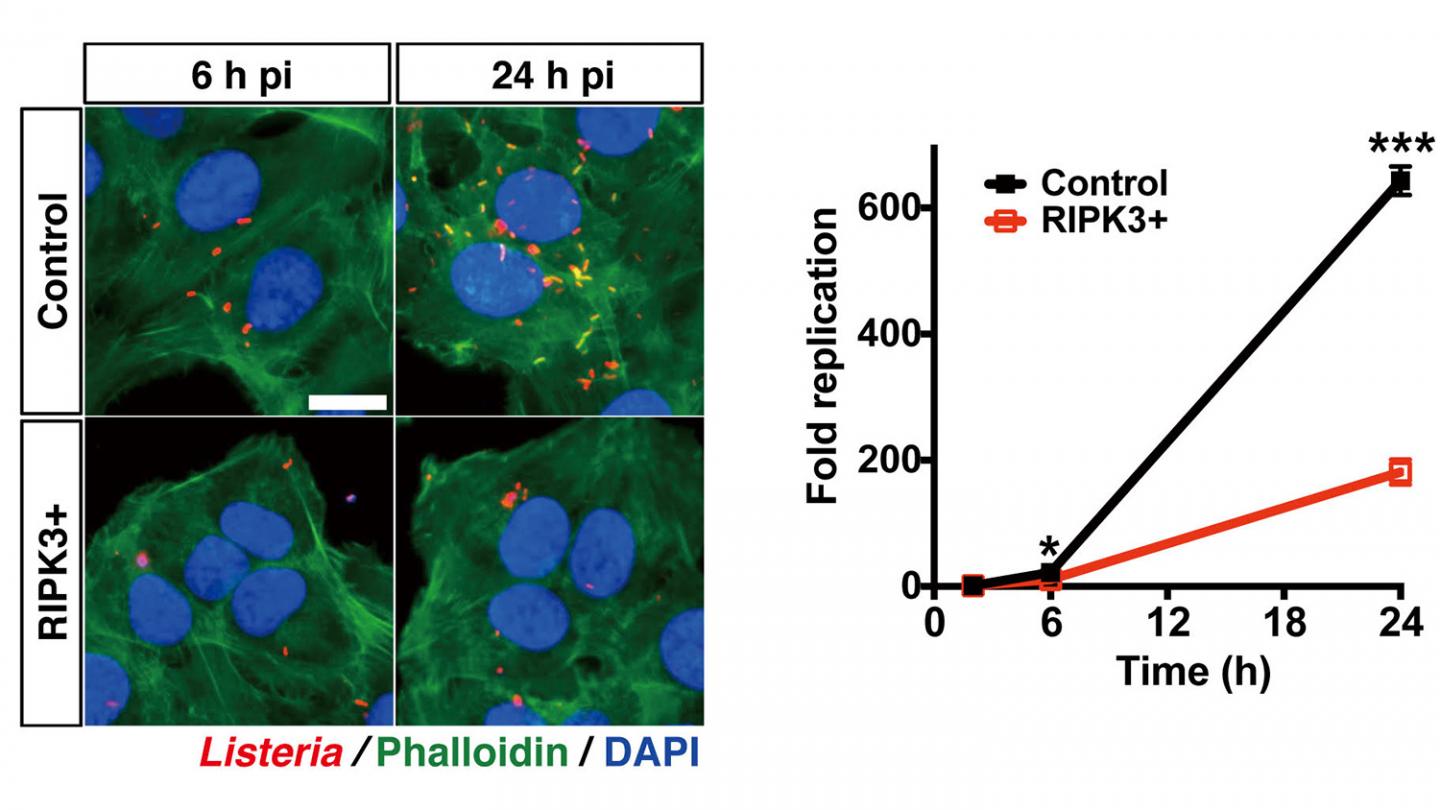
محققان تنها توانستهاند پروسههای زیست شناختی را که منجر به التهاب مزمن حاصل از رژیم غذایی غلط در موشها بروز میکند را شناسایی کنند علاوه بر این، دانشمندان MDA را یک عامل کلیدی در التهاب کبدی میدانند که میتواند با آنتیبادیهای طبیعی خنثی شود.
مالوندیآلدهید مولکول بسیار واکنشی، محصولی از تجزیه چربی و بیومارکر استرس اکسیداتیو است که بر روی سطح سلولهای مرده در کبد تجمع مییابد. این مولکول به طور شیمیایی به پروتئینهای غشایی و یا فسفولیپیدها متصل میشود و به این ترتیب اپیتوپهای MDA را تشکیل میدهد. گروه تحقیقاتی نشان داد که این اپیتوپهای MDA باعث ایجاد ترشح سیتوکین و همچنین استخراج لکوسیتها میشود و در نتیجه باعث التهاب میگردد.
محققان نقش مهم این اپیتوپهای MDA را در التهاب کبدی ناشی از رژیم غذایی بررسی کردهاند. با تزریق داخل وریدی از یک آنتی بادی MDA خاص که به طور انتخابی به اپیتوپهای MDA متصل میشود، میتوان التهاب را در موشها بهبود بخشید. این مطالعه نشان میدهد که با بررسی توالی RNA و تجزیه و تحلیل بیوانفورماتیک دادههای مربوط به ترجمه، مکانیزمهای کلیدی در برخی از بیماریهای شایع را میتوان بررسی کرد که این یافتهها در مدلهای موش تایید میکند که استفاده از آنتیبادیهای خاص برای اپیتوپهای MDA یک رویکرد جدید امیدوار کننده برای توسعه استراتژیهای درمانی میباشد.
منبع:
Busch, C.J.L., Hendrikx, T., Weismann, D., Jäckel, S., Walenbergh, S., Rendeiro, A.F., Weißer, J., Puhm, F., Hladik, A., Göderle, L. and Papac‐Milicevic, N., 2017. Malondialdehyde epitopes are sterile mediators of hepatic inflammation in hypercholesterolemic mice. Hepatology, 65(4), pp.1181-1195.