براساس مطالعه جدیدی که در مجله Cell Metabolism منتشر شده است ، انتقال اطلاعات ژنتیکی حیاتی در داخل سلول، مخابره یک طرفه نیست. میتوکندری ساختارهایی است که درون سلولها بیشتر برای تبدیل مواد مغذی به انرژی قابل استفاده، شناخته میشود.
بیشتر مواد ژنتیکی در هسته ساکن هستند و DNA بزرگترین ماده سلول است که الگوهای رمزگذاری شده را ارسال میکند و اعمال انجام شده در سلول را مشخص میکند.
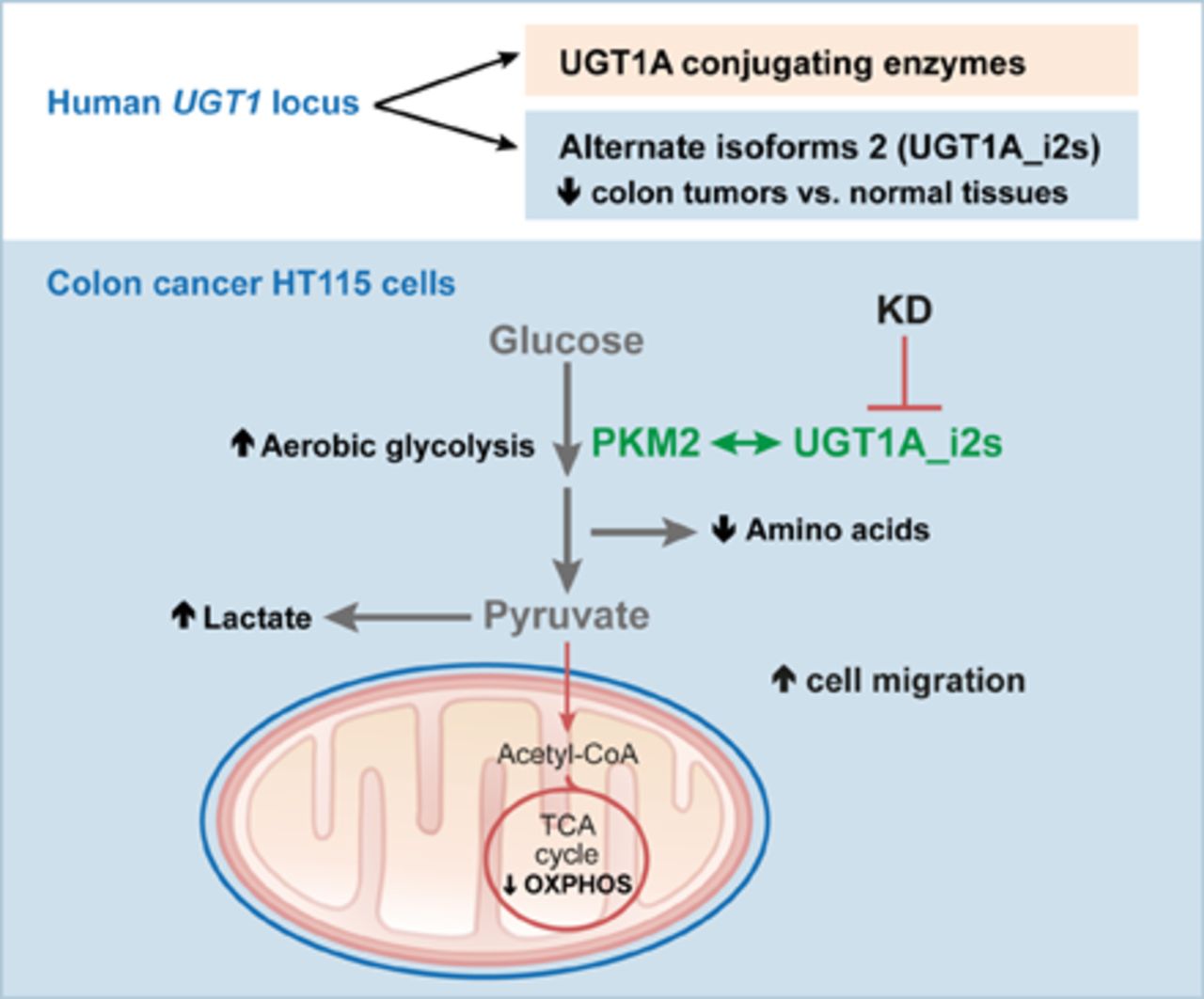
میتوکندریها همچنین حاوی DNA هستند ،که همه از مادر به ارث رسیدهاند ، و همانطور که مطالعه جدید نشان میدهد ، میتوکندریها فقط دستوراتی از هسته دریافت نمیکنند بلکه خود نیز دستوراتی جهت کنترل سلول صادر میکنند.
دکتر چنگان دیویدلی ، نویسنده ارشد ، از دانشگاه کالیفرنیای جنوبی لس آنجلس ، مرکز جامع سرطان میگوید: “میتوکندریها DNA خود را دارند که احتمالاً از باکتریهای باستانی که مدتها قبل به سلولهای ما پیوستهاند ، منشا گرفته است. ما نمیدانستیم که DNA میتوکندری، پیامهایی را برای کنترل هسته رمزگذاری میکند.”
این یک کشف اساسی است که دو ژنوم، سلول را به عنوان یک سیستم ژنتیکی همزمان تکامل میبخشد و ممکن است تأثیر ماندگار برای طیف گستردهای از زمینههای علمی و پزشکی داشته باشد.
وی افزود: “دانستن چگونگی ارتباط DNA درون سلول و DNA میتوکندری سخت میشود و محققان بیشتری را به درک هماهنگی ژنهای رمزگذاری شده در هر دو ژنوم و نقش آنها در پیری و بیماریها سوق میدهد. یافتههای ما قابل توجه است زیرا پیری باعث تجزیه سلولها میشود و منجر به بیماریهایی مانند سرطان و آلزایمر میگردد.”
دکتر لی و همكاران آنها با همكاری سلولهای انسانی كشف كردند كه وقتی سلول در معرض استرس است و برای مواد مغذی گرسنه است ، MOTS-c ، پروتئین كمی رمزگذاری شده در DNA میتوكندری ، برای كنترل ژنها در هسته، فعال میشود و كنترل ژنها را فعال میكند. از جمله پاسخ آنتیاکسیدانی که در شرایط استرس اکسیداتیو توسط ژنهای میتوکندری فعال میشود.
محققان گفتند: “دانستن نحوه عملکرد سلولها میتواند منجر به درک بیشتر بیماریهای مرتبط با سن و شاید درمانهای جدید مبتنی بر میتوکندری، بر این اساس پایهگذاری شود.”
داروهای تجویزی امروزه براساس طرح كدگذاری شده در ژنوم هستهای طراحی شدهاند.
محققان به دنبال پیچیدگی کامل شبکه سلولی نبودهاند. اگر مثلاً تنها با نیمی از ژنوم خود با سرطان مبارزه کنیم ، این تنها نیمی از راهحل خواهد بود. اکنون میتوانیم با تمام مؤلفههای ژنتیکی خود با این بیماریها مبارزه کنیم.
منابع:
Kim, K.H., Son, J.M., Benayoun, B.A. and Lee, C., 2018. The mitochondrial-encoded peptide MOTS-c translocates to the nucleus to regulate nuclear gene expression in response to metabolic stress. Cell metabolism, 28(3), pp.516-524.