محققان دانشگاههای کارولینای جنوبی، دوک، آلاباما و… روش تازه ای را که درهای بسته درمان کبد چرب غیر الکلی را میگشاید، کشف کردند. بیماریی که ۲۵ درصد جمعیت کره زمین را به سمت سیروز کبدی، سرطان کبد و اختلال در عملکرد کبد هدایت میکند.
کبد همواره به عنوان یک آزمایشگاه مرکزی برای سوخت و ساز در میان مهرهداران مطرح است. کبد چرب غیر الکلی عنوان بیماری ای است که تحت تاثیر تولید بیش از چربی (به مقدا بیش از ۱۰-۵ درصد وزن کل کبد) توامان با التهاب کبدی بوقوع میپیوندد.
این بیماری کودکان و بزرگسالان را مبتلا ساخته و در افراد چاق و دارای اضافه وزن، مبتلایان به دیابت نوع دوم، افراد با میزان کلسترول و تری گلیسیرید بالا ریسک ابتلا به کبد چرب غیر الکلی بسیار بیشتر از افراد عادی است. در افرادی که فاقد ریسک فاکتورهای مذکور میباشند دلیل ابتلا به کبد چرب غیر الکلی ممکن است به دلیل عوامل ژنتیکی باشد.
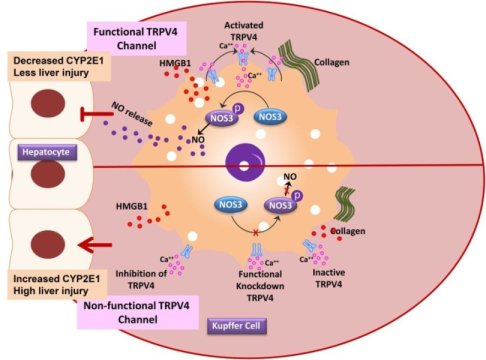
مطالعه پژوهشگران دانشگاههای مذکور در مجله رادیکالهای آزاد و پزشکی (free radicals & medicine) به چاپ رسیده است که یکی از نشریات معتبر در زمینه استرس اکسیداتیو و پزشکی میباشد. تیم محققان پروتئین (TRPV4) را که یکی از عوامل دفاعی بدن نیز به شمار میرودو قادر به فعال نمودن گاز نیتریک اکساید میباشد را در کبد کشف نمودند.این گاز آنزیم (CYP2E1) را که یکی از فاکتورهای دخیل در بیماری کبد چرب غیر وابسته به الکل و پیشرفت آن میباشد را مهار میکند. پیش از این TRVP4 به عنوان یکی از عوامل محافظت کننده سیستم قلب و عروق در اختلالات سیستم قلبی و عروقی مطرح بوده است.
هم اکنون این پروتئین برای ممانعت از ایجاد کبد چرب غیر الکلی شناخته شده است و گام بعدی در این مسیر به کار بستن توانایی این پروتئين در پیشگیری و درمان کبد چرب خواهد بود. با توجه به ادعای محققان میتوان نسل جدید از آگونیستهای TRPV4 را برای بهبود نتایج درمان کبد چرب غیر الکلی استفاده نمود. آگونیستها موادی شیمیایی هستند که به این پروتئین متصل شده و منجر به آزاد شدن نیتریک اکساید جهت جلوگیری از فعالیت آنزیم مضر TRPV4 خواهد شد. آگونیست مناسب این پروتپین پیش از این شناخته شده و قادر به ترکیب شدن با پروتئین مورد نظر میباشد.
به گفته یکی از محققان دانشگاه کارولینای جنوبی: در حال حاضر هیچ داروی تثبیت شده ای برای درمان کبد چرب غیر الکلی وجود ندارد و تمام تلاش بر این است که روشی نوین در کبد برای درمان بیماری آن شناسایی شود، روش جدید بایستی بر پایه مکانیسم دفاعی داخلی در کبد خواهد بود.
علاوه بر فواید فعال شدن TRPV4 محققان در رابطه با نتیجه مهار کانالهای یونی این پروتئین هشدارهایی دادند که خود میتواند منجر به مسمویت کبدی شود که بسیار مشابه با مسمومیت کبد در اثر استفاده بیش از حد استامینوفن و یا الکل میباشد. این بدین معناست که اگر در فرد بیماری TRPV4 به عنوان درمان استفاده شود بایستی مراقب مواردی ماننده درد، التهاب، خارش و حساسیت بود چراکه در شرایط مذکور مهار این پروتپین توسط مهارکنندههای سیستمیک آن رخ میدهد. برای رهایی از مشکل مطرح شده میتوان از ترکیبات فعال کننده TRPV4 با منشا گیاهی که قادر به به القا تغییرات تدریجی در کبد و ایجاد تغییرات ژنتیکی سلولهای کبدی با تسهیل روند سیگنالینگ TRPV4 در درمان کبد چرب غیر الکلی استفاده نمود. از این رو میتواند یک روش مناسب برای حفظ تعادل در مهار و فعالیت TRPV4 برای درمان التهاب، درد، بیماریهای فیبروتیک، ادم ریه و برای اجتناب از آسیبهای کبدی استفاده نمود.
منبع
Ratanesh K. Seth, Suvarthi Das, Diptadip Dattaroy, Varun Chandrashekaran, Firas Alhasson, Gregory Michelotti, Mitzi Nagarkatti, Prakash Nagarkatti, Anna Mae Diehl, Darwin P. Bell, Wolfgang Liedtke, Saurabh Chatterjee. TRPV4 activation of endothelial nitric oxide synthase resists nonalcoholic fatty liver disease by blocking CYP2E1-mediated redox toxicity. Free Radical Biology and Medicine, 2016; DOI: 10.1016/j.freeradbiomed.2016.11.047