بیومارکر چیست ؟ ( قسمت اول )
بیومارکرهای سرطان ( قسمت دوم )
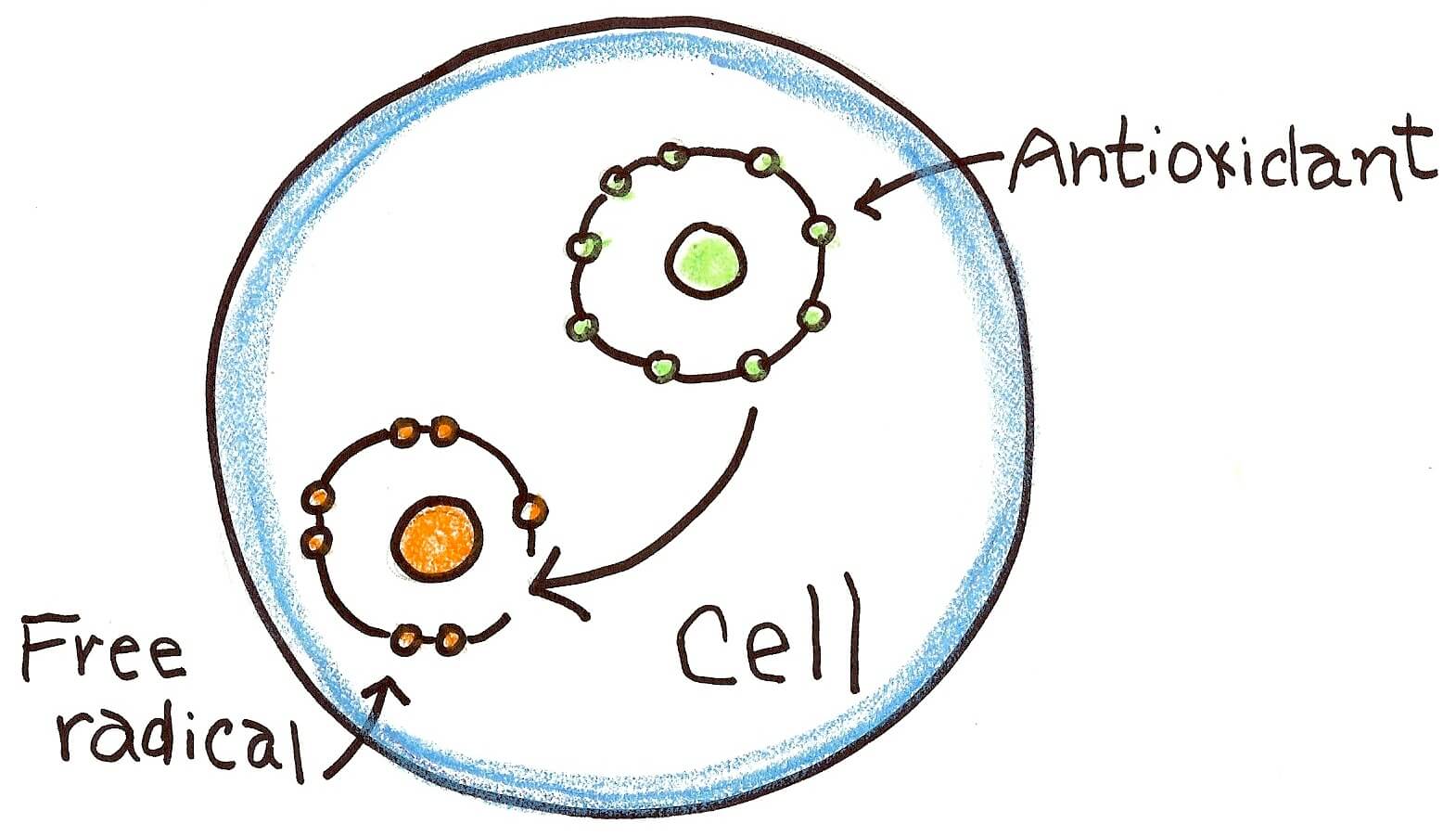
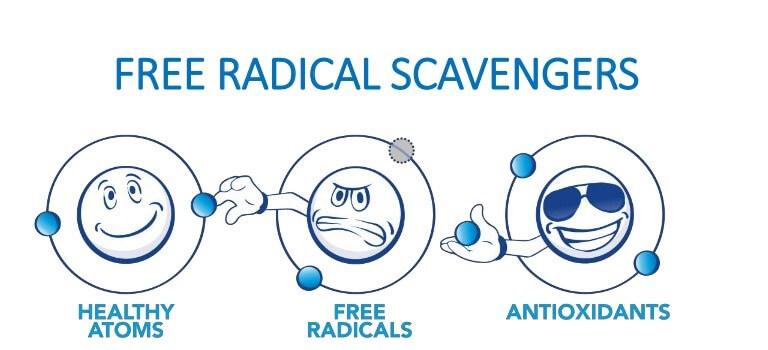
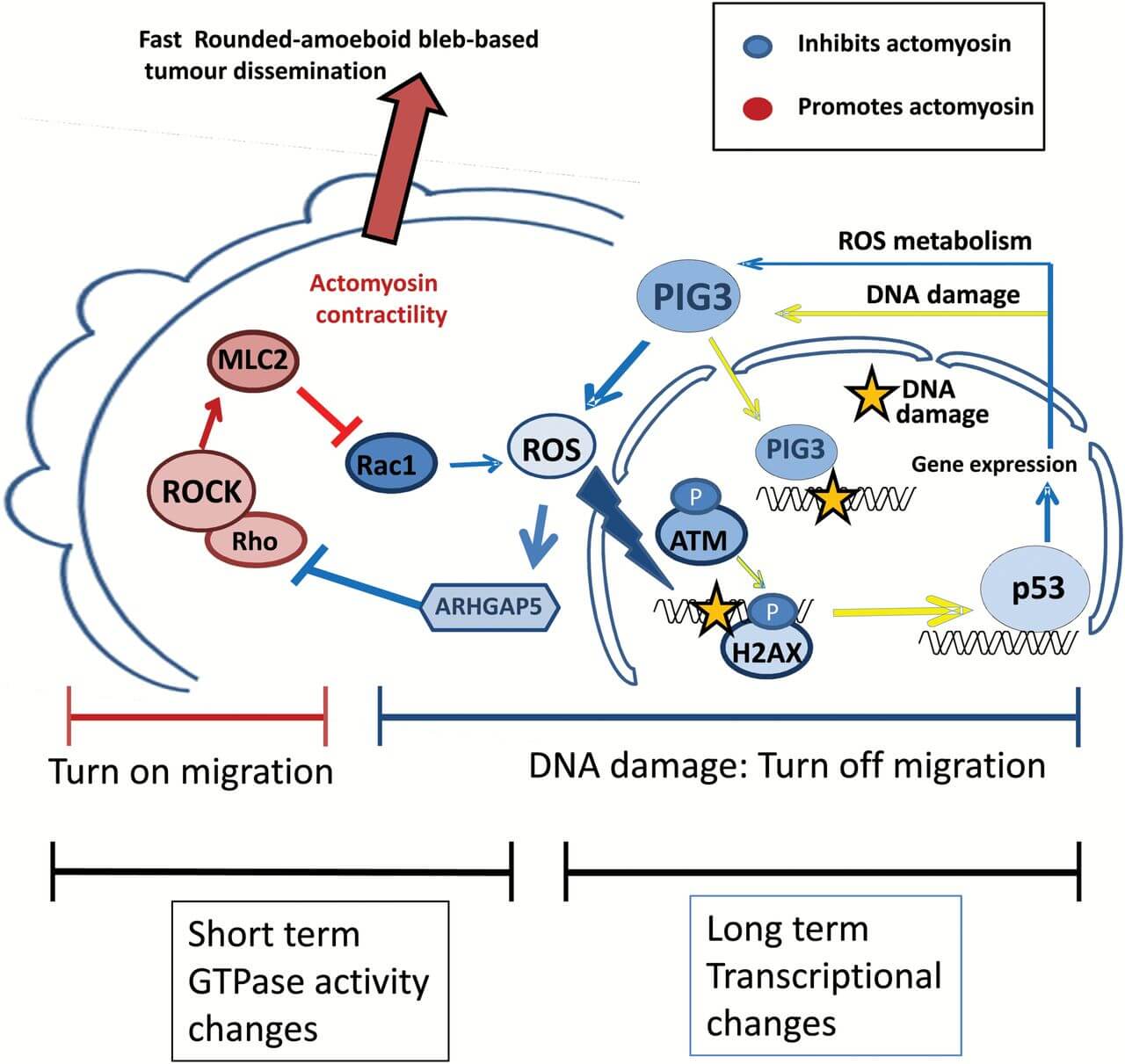
استرس اکسیداتیو، قسمت سمی اکسیژن و متابولیسم را نشان میدهد. استرس اکسیداتیو به عنوان عدم تعادل بین اکسیدانها و آنتیاکسیدانها به نفع اکسیدانها شناخته شده که منجر به اختلال در سیگنالینگ مجدد، کنترل چرخه سلولی و آسیب مولکولی میشود.
بیومارکرهای استرس اکسیداتیو به سه دسته اصلی تقسیم میشوند:
– گونههای فعال اکسیژن ROS
– DNA / RNA، چربیها و پروتئینهایی که توسط اکسیداسیون آسیب دیدهاند
– آنتیاکسیدانها
درباره این سه گروه این توضیح را باید افزود که:
– ROS نشاندهنده عواملي هستند كه استرساكسيداتيو را تحريك مي كنند و باعث آسیب به اجزاي سلول میشوند.
– آسیب DNA / RNA، پراکسیداسیون لیپید و اکسیداسیون / نیترات پروتئین، آسیبهای ناشی از اکسیداسیون را نشان میدهد
– آنتیاکسیدانها سیستمهای مبارزه با استرس اکسیداتیو را نشان میدهند
• گونه فعال اکسیژن ROS
گونه فعال اکسیژن، گونههای شیمیایی واکنشی هستند که حاوی اکسیژن فعال میباشند. آنها عبارتند از پراکسید، سوپراکسید، هیدروکسیل رادیکال، اکسیژن مجزا و آلفا اکسیژن.
با توجه به ماهیت گذار آنها، به راحتی در سلولهای زنده با استفاده از تستهای رنگسنجی، مانند DCFDA، اندازهگیری میشوند. این بیومارکرها قابل اندازهگیری در خون، پلاسما، بافت و ادرار هستند.
• آسیب DNA / RNA، پراکسیداسیون لیپید، و اکسیداسیون / نیترات پروتئین
استرس اکسیداتیو را میتوان به طور غیرمستقیم با اندازهگیری سطوح آسیب DNA / RNA، پراکسیداسیون لیپید و اکسیداسیون / نیترات پروتئین، به جای اندازهگیری مستقیم گونههای فعال اکسیژن، اندازهگیری کرد. بیومارکرهای استرس اکسیداتیو پایدارتر از انواع اکسیژن فعال هستند.
آسیب DNA / RNA
انواع مختلفی از آسیب DNA / RNA وجود دارد که میتواند به عنوان بیومارکرهای استرس اکسیداتیو اندازهگیری شود. 8-hydroxydeoxyguanosine احتمالا به عنوان یکی از رایج ترین بیومارکرهای آسیب DNA برای استرس اکسیداتیو است. تستهای مکانهای apurinic / apyrimidinic و آزمونهای آسیب ناشی از آلدهید میتواند به عنوان اندازهگیریهای مستقیم از آسیب DNA استفاده شود که به طور بالقوه مرتبط با استرس اکسیداتیو است.
پراکسیداسیون لیپید
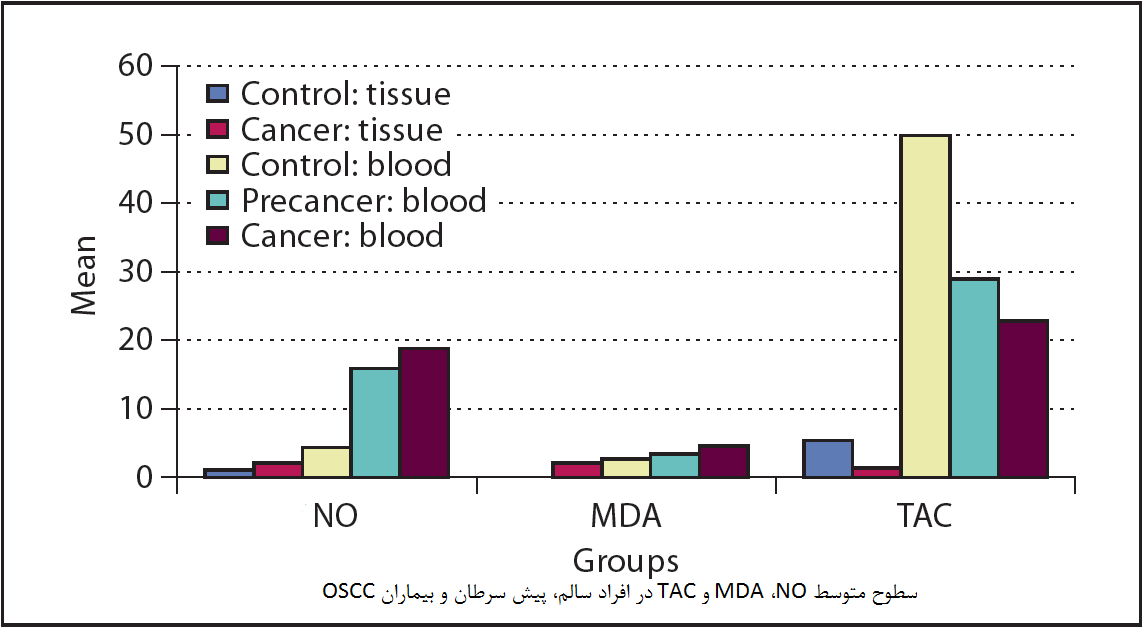
مالوندیآلدئید MDA یکی از معمولترین شاخصهای لیپیدی استرس اکسیداتیو است. این ماده از طریق پراکسیداسیون اسیدهای چرب غیراشباع تشکیل شده است و معمولا با استفاده از آزمون TBARS اندازهگیری میشود. تست TBARS به طور کامل برای MDA خاص نیست، همانطور که سایر آلدهیدها نیز سیگنال مشابهی را با این تست تولید میکنند، با این حال، تست TBARS عموما راحتتر از استفاده از HPLC برای اندازه گیری MDA است. آزمونهای ELISA رقابتی برای MDA نیز در دسترس هستند.
دیگر بیومارکرهای پراکسیداسیون چربی شامل 4-HNA، 8-ایزوپروستان، هیدروپراکسید لیپیدها و LDL اکسید شده است.
اکسیداسیون / نیترات پروتئین
آسیب اکسیداتیو به پروتئینها میتواند به شکل کربن لیپتین پروتئین و نیتراسیون پروتئین (3-نیتروتیروزین) باشد. گونههای فعال اکسیژن همچنین میتوانند تولید محصولات پیشرفته گلیکوزیله AGE و پروتئینهای AOPP را ایجاد کنند. همه این بیومارکرها را میتوان با روشهای استاندارد اندازهگیری کرد.
• آنتیاکسیدانها
آنزیمهای آنتیاکسیدانی و دیگر مولکولهای ROS، باعث آسیب اکسیداتیو می شوند. سه نوع آنتیاکسیدان به عنوان بیومارکر استرس اکسیداتیو وجود دارد: مولکولهای کوچک، آنزیمها و پروتئینها (مانند آلبومین).
برای اندازه گیری ظرفیت کلآنتی اکسیدانی نمونه، از جمله مولکولکوچک و ظرفیت آنتیاکسیدانی پروتئین، تعدادی از تستها وجود دارد. یکی از رایجترین تستهای کلسترول آنتیاکسیدانی، تست آنتیاکسیدانیTEAC است. تست آنتیاکسیدانی رادیکال اکسیژن ORAC یکی دیگر از آزمونهای معمول استرس اکسیداتیو است که ظرفیت آنتیاکسیدان را با اندازهگیری توانایی آنتیاکسیدانها برای کاهش رنگ فلورسنت توسط ROS اندازهگیری میکند.
فعالیت آنتیاکسیدانی نیز میتواند در سطح آنالیتهای خاص اندازهگیری شود. به عنوان مثال با نگاه کردن به سطوح نسبی GSH و GSSG ، سطح آنالیت اندازهگیری میشود. گلوتاتیون احیا GSH به عنوان مولکولی فراوان در میان آنتیاکسیدانهای درون سلولی در نظر گرفته میشود که GSSG را در فرم اکسید شده تشکیل میدهد. این واکنش توسط آنزیم گلوتاتیون ردوکتاز فعال میشود.
در غیر این صورت، سطح فعالیت آنزیمهای آنتیاکسیدانی مانند GST و سوپراکسیددیسموتاز میتواند در رابطه با سطوح استرس اکسیداتیو اندازهگیری شود.
منابع:
Valavanidis, A., Vlachogianni, T. and Fiotakis, C., 2009. 8-hydroxy-2′-deoxyguanosine (8-OHdG): a critical biomarker of oxidative stress and carcinogenesis. Journal of environmental science and health Part C, 27(2), pp.120-139.
Nielsen, F., Mikkelsen, B.B., Nielsen, J.B., Andersen, H.R. and Grandjean, P., 1997. Plasma malondialdehyde as biomarker for oxidative stress: reference interval and effects of life-style factors. Clinical chemistry, 43(7), pp.1209-1214.
Lykkesfeldt, J., 2007. Malondialdehyde as biomarker of oxidative damage to lipids caused by smoking. Clinica chimica acta, 380(1-2), pp.50-58.