آنتیاکسیدان قدرتمند میتواند پیشرفت بیماری کبد چرب در موشهای جوان را متوقف کند
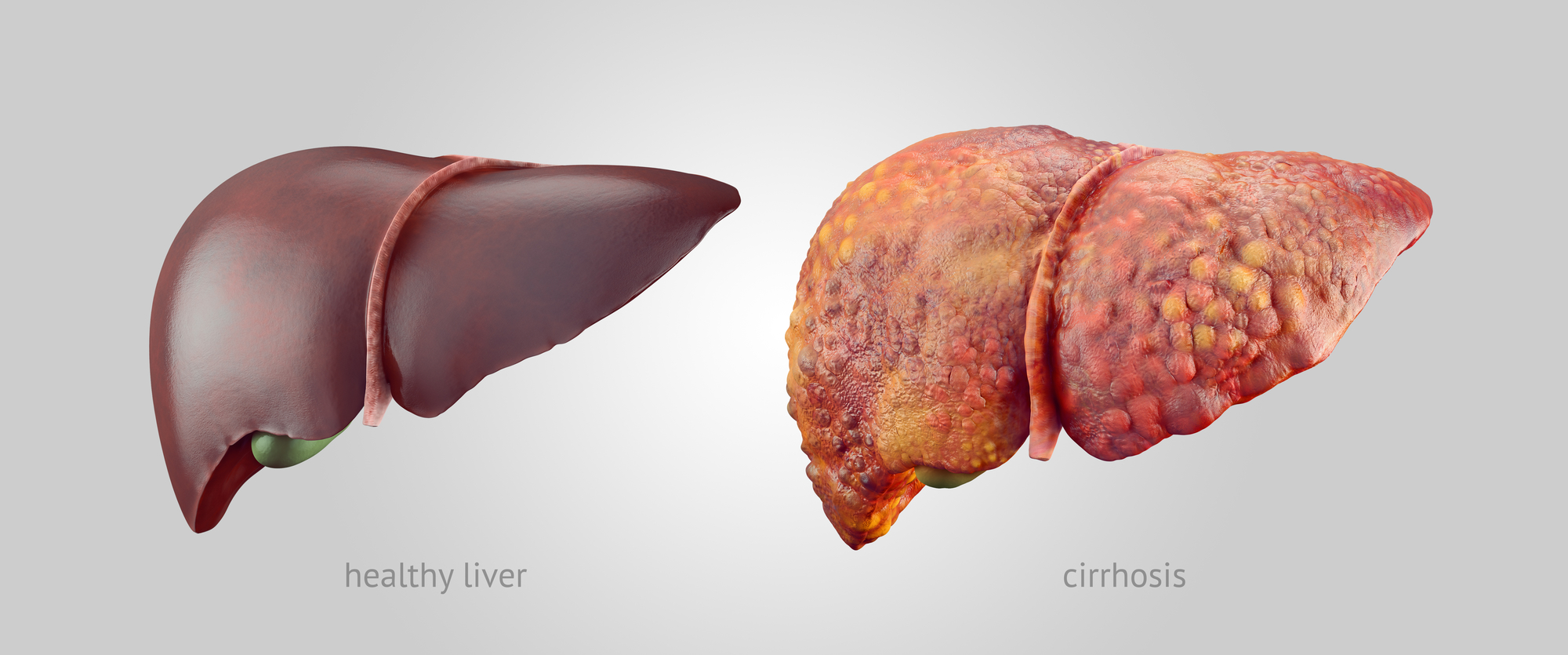
با افزایش چاقی در ایالات متحده ، بیماری کبد چرب غیر الکلی (NAFLD) به یک موضوع مهم بهداشت عمومی تبدیل شده است و به طور فزایندهای منجر به سرطان و پیوند کبد میشود.
اما تحقیقات جدید در دانشگاه پزشکی کلرادو Anschutz پردیس پزشکی نشان میدهند که یک آنتیاکسیدان قدرتمند که در میوه کیوی ، جعفری ، کرفس و پاپایا معروف به پیرولوکینولین کینون یا همان PQQ یافت میشود ، میتواند جلوی پیشرفت بیماری کبد چرب در موشهای جوان را بگیرد یا از آن جلوگیری کند. موشها از رژیم غذایی پرچرب به سبک غربی تغذیه کردند.
این مطالعه ، که امروز در مجله Hepatology Communications منتشر شد ، توسط کارن جونچر ، دکترا ، دانشیار بیهوشی و فیزیکدان در CU Anschutz انجام شد. شواهد در حال رشد نشان میدهد که چاقی و بیماری کبد چرب در کودکان تحت تأثیر رژیم غذایی مادر، میکروبیوم شیرخوار و جامعه میکروارگانیسمهای ساکن بدن است. جونچر و همكارانش دریافتند كه موشهای مادر از رژیم غذایی غربی استفاده میكنند و تأثیرات منفی آن رژیم بر فرزندانشان میگذارد.
کار قبلی جونچر در زمینه PQQ نشان داد که این امر به بازگشت این اثرات مضر در موشهای تازه متولد شده در فرمهای خفیفتر بیماری کبد کمک کرده است. در این مطالعه ، وی نشان داد که روی میکروبیوم فرزندان اولیه نیز کار میکند تا از ابتلا به بیماری کبد چرب جلوگیری کند. طی یک دهه گذشته ، مشخص شده است که میکروبیوم روده در حال رشد بر بلوغ سیستم ایمنی و دستگاه گوارش ، متابولیسم و رشد مغز تأثیر میگذارد. جونچر گفت: “شواهد به طور فزاینده نشان میدهد كه قرار گرفتن در معرض چاقی مادر باعث ایجاد محیطی التهابی در رحم میشود.
چاقی ، که غالباً ناشی از رژیم غذایی پرچرب ، کلسترول و قند خون است ، دلیل اصلی NAFLD است. براساس ژورنال انجمن پزشکی آمریکا ، تقریباً 60 درصد از زنان آمریکایی در سن باروری ، دارای اضافه وزن یا چاقی هستند. مطالعات بیشماری حاکی از آن است که کودکانشان تمایل به افزایش چربی کبد و خطر چاقی بیشتر دارند. جونچر گفت: “بیماری کبد چرب بیماری شماره یک کبد در جهان است.” “این اکنون علت اصلی پیوند کبد ، گرفتگی هپاتیت در بسیاری از مناطق ایالات متحده است.” محققان دریافتند که آنها میتوانند با تغذیه PQQ مادران خود از بروز بیماریهای کبدی در موشهای جوان جلوگیری کنند.
“نتایج ما حاکی از اهمیت دوره نوزادی به عنوان یک پنجره رشدی مهم برای محافظت از فرزندان چاق در برابر اثرات مضر لیپوتوکسیک ناشی از رژیم غذایی است و به طور بالقوه روند ویران کننده افزایش NAFLD کودکان در ارتباط با چاقی کودکان را متوقف میکند.” جونچر خاطرنشان كرد كه باید مشخص شود آيا اين مطالعات ممكن است براي انسان نيز كار بيشتري انجام شود.
وی گفت: “اما این احتمال وجود دارد که افراد مبتلا به بیماری کبد چرب به طور بالقوه سود ببرند.” “این مکمل به صورت آنلاین و در فروشگاه های مواد غذایی موجود است اما افراد قبل از استفاده باید ابتدا با پزشکان خود مشورت کنند.”
منابع:
Pak, W., Takayama, F., Mine, M., Nakamoto, K., Kodo, Y., Mankura, M., Egashira, T., Kawasaki, H. and Mori, A., 2012. Anti-oxidative and anti-inflammatory effects of spirulina on rat model of non-alcoholic steatohepatitis. Journal of clinical biochemistry and nutrition, pp.12-18.
Perlemuter, G., Davit‐Spraul, A., Cosson, C., Conti, M., Bigorgne, A., Paradis, V., Corre, M.P., Prat, L., Kuoch, V., Basdevant, A. and Pelletier, G., 2005. Increase in liver antioxidant enzyme activities in non‐alcoholic fatty liver disease. Liver international, 25(5), pp.946-953.