دانشمندان JILA یک روش آمادهسازی نمونه سریع و ساده را توسعه دادهاند که تصویربرداری از DNA را بهبود میبخشد تا خواص فیزیکی و تعاملات آن را بهتر تحلیل کند. روند ملایم و در عین حال موثر JILA شامل اتصال DNA به میکا، یک ماده معدنی سیلیکات صاف است. این روند پیکربندی DNA را گسترش میدهد به طوری که هشت برابر بیشتر از مولکول میتواند در مقایسه با روشهای قبلی تجزیه و تحلیل شود.
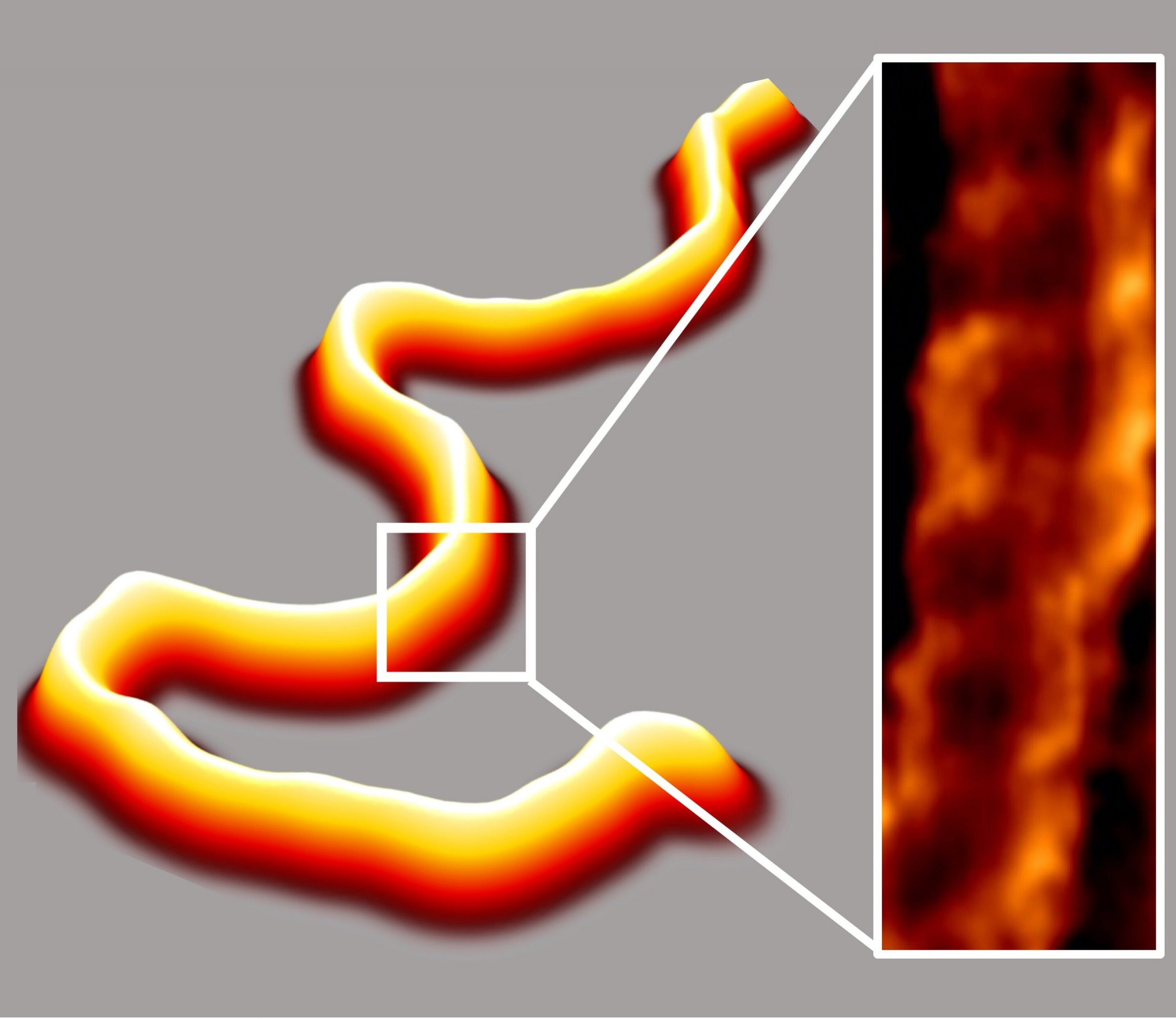
تصویربرداری با میکروسکوپ نیروی هسته ای (AFM) از ساختارهای توسعه یافته در مایع، کیفیت و کمیت دادههای بیوفیزیکی DNA و تعامل آن با پروتئین را بهبود میبخشد. این روش، تصاویری با کیفیت بالا را در طیف گستردهای از غلظت نمک، از جمله آنهایی که در سلولهای مشابه یافت میشود، تولید میکند. ابتدا تصور میشد این روش غیرممکن است زیرا نمکهای مختلف معمولا برای اتصال DNA به سطح، رقابت میکنند. تصاویر با وضوح بالا نشان داد که ساختار مارپیچ DNAمانند نردبان پیچ خورده است.
محققان انتظار دارند که این روش جدید، آمادهسازی نمونه برای تسهیل تنظیم قدرت اتصال DNA به سطح را آسان تر کند.
تصویربرداری AFM از DNA قبلا در هوا و مایع انجام شده است، اما هیچ روش گستردهای برای تهیه DNA در مایع، محیط طبیعی آن وجود ندارد. میکا یک سطح اتصال جذاب است چرا که بسیار صاف بوده اما همچنان دارای یک بار الکتریکی منفی است، که DNA را دفع می کند. روشهای آمادهسازی فعلی نمونه میتواند قطعات کاملی از DNA، تصاویر ضعیف یا شرایط نمکی را که باعث اختلال در تعاملات پروتئین-DNA میشود، منجر شود.
پروسه پنج دقیقهای JILA شامل پیشگیری از میکا در محلول نیکل-نمک، شستشوی ملایم و خشک و اتصال DNA به میکا در محلول حاوی کلرید منیزیم و کلرید پتاسیم میباشد. همانطور که در یک سلول، این شرایط نمک، خواص پروتئینهای مرتبط با DNA را حفظ میکند. پس از تکمیل اتصال DNA به میکا، مرحله نهایی قبل از تصویربرداری شامل شستشو میکا با محلول حاوی نیکل کلرید است که ساختار DNA را با افزایش اثر متقابل DNA میکا به دام میاندازد.
برای اولین بار در مایع، روش تولید تصاویر AFM از DNA به سطح تخت بدون تغییرات در خواص آن شناخته شده است. دانشمندان JILA از روش جدید برای ساخت تصاویر با کیفیت بالا از DNA و دو پروتئین DNA استفاده کردند. تصاویر پیشرفته از تجمعهای پروتئین DNA کمک میکند تا محققان جزئیات جدیدی از فرآیندهای مانند تعمیر DNA و متابولیسم سلولی را بیابند.
منابع:
Heenan, P.R. and Perkins, T.T., 2019. Imaging DNA Equilibrated onto Mica in Liquid Using Biochemically Relevant Deposition Conditions. ACS nano.
Zheng, J., Li, Z., Wu, A. and Zhou, H., 2003. AFM studies of DNA structures on mica in the presence of alkaline earth metal ions. Biophysical chemistry, 104(1), pp.37-43.