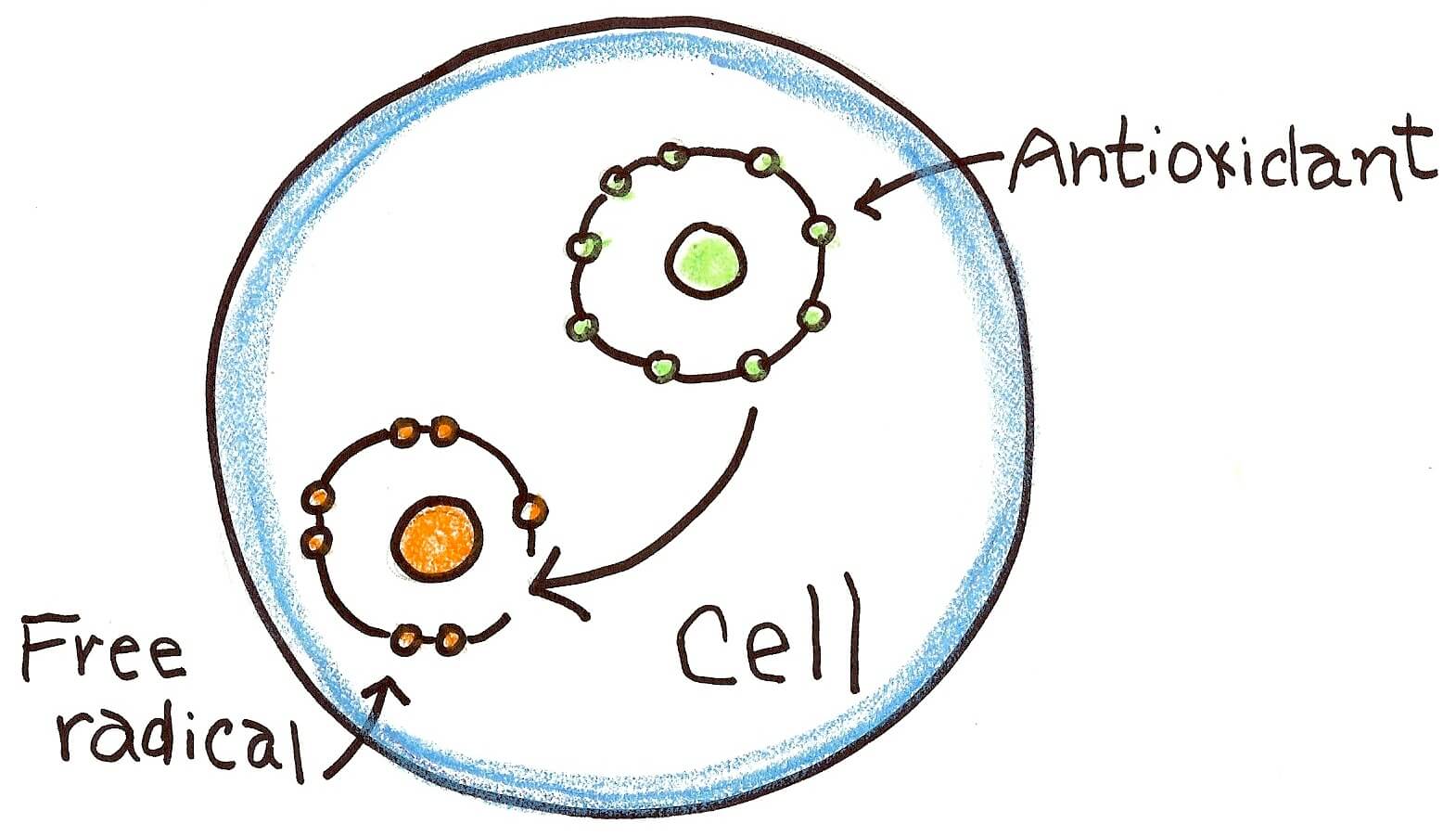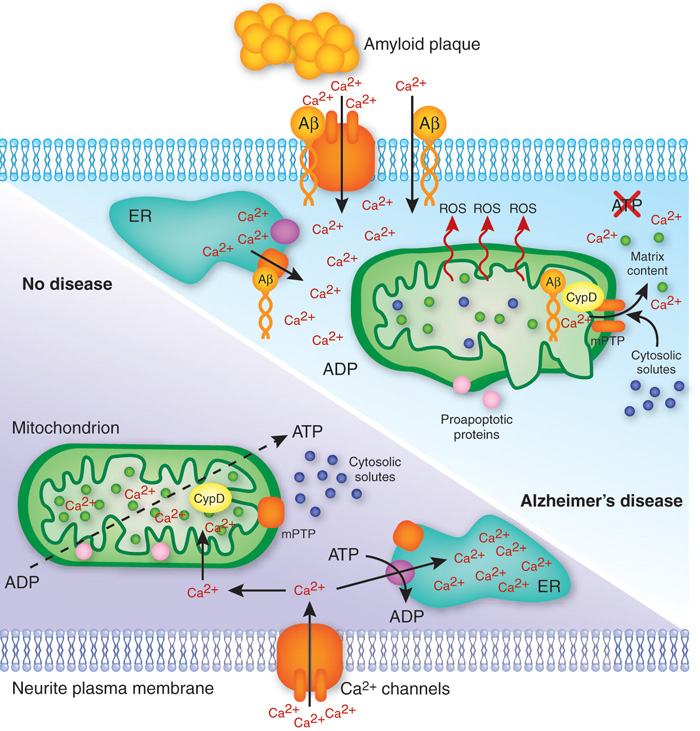
باور بر اینست که میتوکندری به عنوان منبع اصلی رادیکالهای آزاد در سلول، با سطح بالایی از استرس اکسیداتیو نقش مهمی در پاتوژنز بیماری آلزایمر ایفا می کند. در حال حاضر مطالعهی جدیدی در آزمایشگاه دکتر روبرتا بریتون، دانشگاه کالیفرنیای جنوبی نشان می دهد که استروژن، استرس اکسیداتیو ناشی از تولید انرژی توسط میتوکندری را کاهش می دهد. اهمیت مسئله در اینست که در بیماری آلزایمر معمولا کاهش سطح انرژی در مغز پدیدار میشود. میتوکندری اندامک کوچک داخل سلولی است که با استفاده از یک فرآیند به نام اکسیداتیو فسفوریلاسیون تولید بخش اعظم مولکولهای ATP (که سلول برای عملکرد درست از آنها استفاده میکند) را بر عهده دارد.
اگر میتوکندری با گذشت سن و یا بیماری کمتر کارآمد شود، در طول این فرایند از اکسیژن کمتری استفاده خواهد کرد. این ناکارآمدی یک ضربه دو کاره برای مغز خواهد بود: از یک طرف مولکولهای انٰرژی کمتری تولید خواهد شد و از طرف دیگر رادیکالهای آزاد بیشتری رها و در نتیجه منجر به آسیب خواهد شد. تیم تحقیقاتی دکتر برینتونز با استفاده از روش ترکیبی بیوشیمیایی و پروتئوم ( پروتئومیكس) توانست نقش محوری استروژن در تنظیم عملكرد میتوكندری برای محافظت از آلزایمر را به اثبات برساند.
این روشها شامل:
- افزایش بهرهوری میتوکندری، افزایش توانایی اندامک برای تولید مولکول انرژی (ATP) مورد نیاز مغز
- افزایش بیان پروتئینهای مورد نیاز برای تولید ATP
- كاهش استرس اكسیداتیو و محافظت از نورونها در برابر آسیبهای اكسیداتیو
- جلوگیری از آپوپتوزیس (مرگ برنامه ریزی شده ) بیش از اندازهی نورونهای مغزی
- و حفاظت از سلولهای عصبی در برابر سموم میتوکندری، که می تواند اختلال در میتوکندری را بیشتر و مرگ سلولی را القا کنند.
دكتر برینتون و تیم تحقیقاتی او در حال بررسی سطح تولید انرژی میتوكندری به عنوان یك بیو ماركر هستند كه می تواند باعث تشخیص بیماری در مراحل اولیه شود، مرحله ای كه فرآیند تخریب سلولهای عصبی باید کند، متوقف و یا درمان در آن تاثیر بیشتری داشته باشد. آنها بر این باورند که اطلاعات جدید در مورد چگونگی تنظیم عملکرد میتوکندری توسط استروژن به روشن شدن مسیر و توسعه نسل جدیدی از داروهای موثر آلزایمر منتج خواهد شد. دکتر برینتون در حال حاضر در حال توسعهی مولکولهای جدید خاص مغزی است که سطح دفاع عصبی در برابر آلزایمر را با استفاده از مکانیسم مشابه استروژن (اما بدون اثرات جانبی منفی آن) ارتقاء دهد.
منبع: