مطالعه جدید بالینی منتشر شده در مجله بیماری آلزایمر، ارتباط بین سطح گلوتاتیون ( GSH ) را با پیشرفت بیماری آلزایمر بررسی کرده است. مطالعات جدید نشان میدهد که امکان بررسی پیشرفت بیماری آلزایمر با سنجش سطح آنتیاکسیدانهای مغز و با استفاده از تکنیکهای غیرتهاجمی وجود دارد.
طبق تحقیقات بالینی پیشرفته،میزان آنتیاکسیدان گلوتاتیون (GSH)، که مغز را در مقابل استرس اکسیداتیو محافظت میکند، در بیماران مبتلا به آلزایمر در مقایسه با افراد سالم به میزان قابل توجهی کاهش یافته است. همانطور که GSH یک آنتیاکسیدان بسیار مهم است که مغز را در برابر رادیکالهای آزاد محافظت میکند، تحقیقات روشهای دیگری را در جهت تشخیص پتانسیل پیشرفت بیماری آلزایمر یا شناخت افرادی که مستعد ابتلا به آلزایمر هستند، ارائه میدهد.
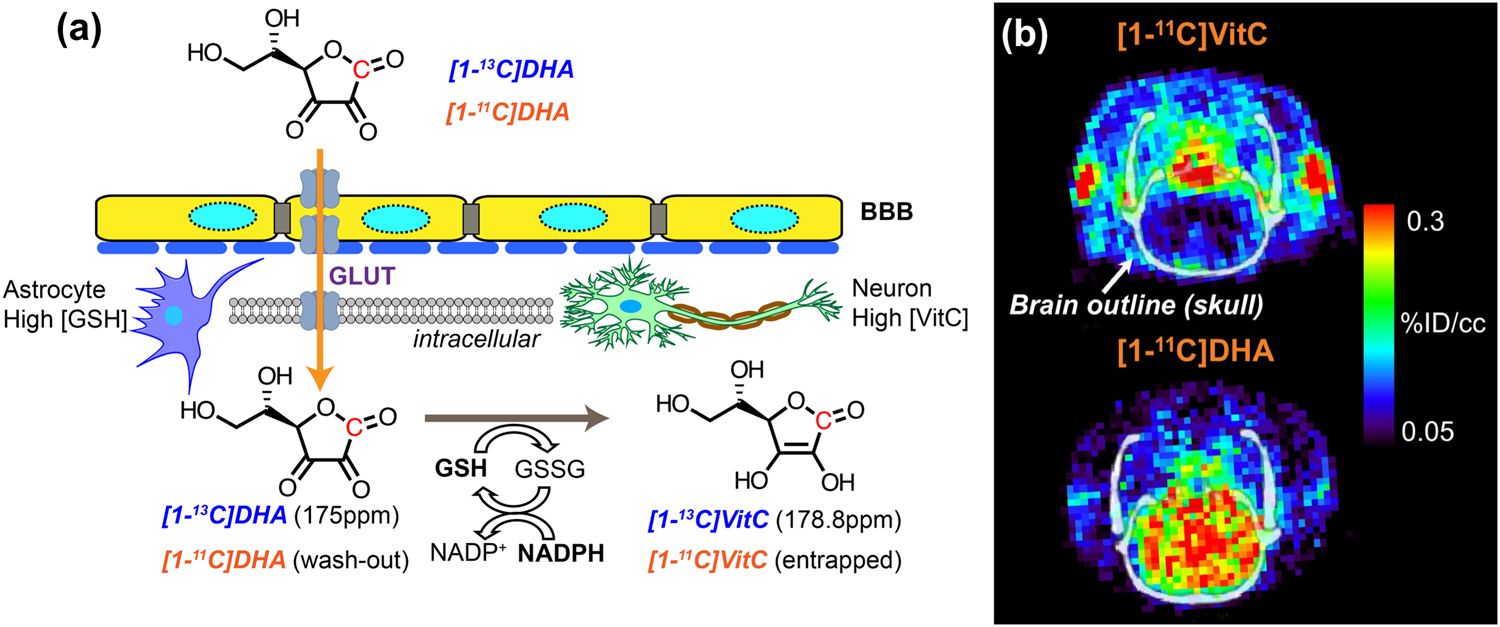
با استفاده از تکنیکهای تصویربرداری غیرتهاجمی، دکتر ماندل و تیم او دریافتند که GSH دارای دو شکل ( بسته و گسترده) در مغز است. هنگامی که GSH در مناطق هیپوکامپ یک فرد مسن تخلیه میشود، مغز سالم دچار اختلال شناختی خفیف (MCI) شده و مراحل اولیه AD را نشان میدهد. در حال حاضر ارتباط بین شکل بسته GSH در بیماران AD تشخیص داده شده است اما هیچ گزارشی مبنی بر ارتباط سطح GSH گسترده و بیماری آلزایمر بررسی نشده است. اما امکان مشاهدات بالینی بیشتری با استفاده از GSH به عنوان مکمل برای مبارزه با پیشرفت AD وجود دارد.
دکتر ماندل: اگر آزمایشات غیرتهاجمی معمول برای بررسی سطح پایین GSH در مناطق هیپوکامپ انجام شود، ممکن است بتوانیم پیشرفت بیماری آلزایمر را با ارائه مکملهای GSH کاهش دهیم.
استرس اکسیداتیو یکی از خصوصیات شناخته شده بیماری AD است. تنظیم مقادیر آنتیاکسیدانها در مبارزه با استرس اکسیداتیو حیاتی است و به همین دلیل کمک میکند تا پیشرفت بیماری آلزایمر را کند کند. گلوتاتیون، آنتی اکسیدان آندوژنیک با فراوانی و عملکرد گسترده و در ارتباط با سیستمهای آنزیمی است که عملکرد آن را تقویت میکند. NAC و GCEE عوامل شناخته شدهاند که میزان گلوتاتیون را در مغز افزایش میدهند. افزایش گلوتاتیون یک استراتژی درمانی نویدبخش برای کاهش یا جلوگیری از بروز بیماری آلزایمر است.
منابع:
Dorszewska, J., Prendecki, M., Florczak-Wyspianska, J., Ilkowski, J., Lagan-Jedrzejczyk, U. and Kozubski, W., 2018. THE APOE GENE CLUSTER POLYMORPHISMS AND OXIDATIVE STRESS FACTORS IN PATIENTS WITH ALZHEIMER’S DISEASE. Alzheimer’s & Dementia: The Journal of the Alzheimer’s Association, 14(7), p.P1156.
Gaucher, C., Boudier, A., Bonetti, J., Clarot, I., Leroy, P. and Parent, M., 2018. Glutathione: Antioxidant properties dedicated to nanotechnologies. Antioxidants, 7(5), p.62.