یک تیم تحقیقاتی در ژاپن برای اولین بار در دنیا پی بردند که ۲-آمینوبوتیریک اسید (2-AB) در متابولیسم آنتیاکسیدانتی تحت عنوان گلوتاتیون دخیل بوده و مصرف آن میتواند سطح این آنتیاکسیدانت را افزایش دهد.
گلوتاتیون، آنتیاکسیدانتی با اثرات آنتیدوتی است که نقش بسیار مهمی در حفظ سلامت دارد. نتایج این مطالعه میتواند در توسعه راههای جدید برای پیشگیری، تشخیص و حتی درمان برخی از بیماریهای مرتبط با استرس اکسیداتیو موثر باشد. این بیماریها طیف وسیعی از آلزایمر گرفته تا پیری و سرطان را شامل میشوند. همچنین بیماریهای مرتبط با سبک زندگی از جمله آرترواسکلروز و آسیبهای ناشی از دارو و سموم را نیز شامل میشوند.
گلوتاتیون اصلیترین آنتیاکسیدانت سلولهای بدن است و نقش سمزدایی مواد بیگانه را دارد. پایش متابولیسم گلوتاتیون از آنجایی که با مواجهه با استرس اکسیداتیو این ماده مورد مصرف قرار میگیرد، میتواند در تشخیص بیماریها موثر باشد. با این وجود سطوح غلظت گلوتاتیون در خون ۱۰۰-۱۰۰۰ برابر کمتر از مقادیر آن در سلول است. از این جهت استفاده از آن به عنوان یک شاخص، دشواریهای خاص خود را دارد. همچنین بدن ما برای مواقع ضروری ذخیره گلوتاتیونی دارد و کاهش سلولی آن بصورت کاهش قابل اندازهگیری در خون نمود نمییابد. از این جهت امکان پایش این ماده تنها با سنجش مقادیر آن در خون مقدور نیست.
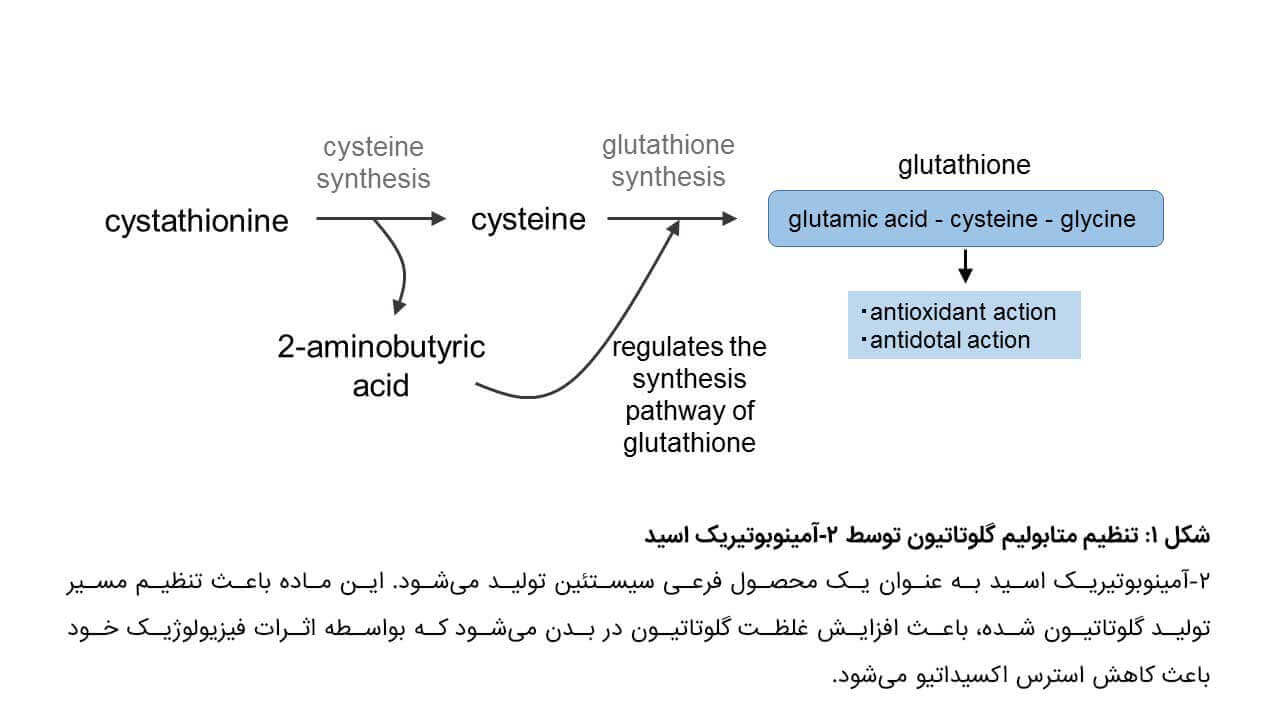
مادهای به نام ۲-آمینوبوتیریک اسید به عنوان بخش اصلی اوفتالمیک اسید شناخته میشود که همزمان با سنتز گلوتاتیون تولید میشود. تاکنون اثرات فیزیولوژیک و متابولیسم 2-AB ناشناخته بود. این گروه تحقیقاتی کار خود را با آنالیز متابولیتهای موجود در خون بیماران مبتلا به عارضه دیواره دهلیز Atrial Septal Defect توسط تکنیک کروماتوگرافی گازی پرداختند. نتایج نشان داد که سطوح 2-AB در این بیماران بالاتر از افراد عادی است و این سطوح پس از برطرف شدن عارضه کاهش یافت. این گروه برای اولین بار دریافتند که 2-AB یک محصول فرعی سیستئین، از آمینواسیدهای سازنده گلوتاتیون است (شکل ۱) همچنین مشخص شد که فعال شدن مسیر سنتز گلوتاتیون در شرایط استرس اکسیداتیو باعث تجمع AB-2 میشود. از آنجایی که مقادیر خونی 2-AB نشانگر متابولیسم گلوتاتیون در بدن است، بنابراین این ماده بصورت بالقوه میتواند بهعنوان بیومارکری برای تشخیص زودهنگام استرس اکسیدایتو مطرح گردد.
به طرز جالبی این گروه تحقیقاتی دریافتند که 2-AB باعث تحریک سنتز گلوتاتیون میشود. داروی ضد سرطان دوکسوروبیسین Doxorubicin با واسطه اثرات سوء خود استرس اکسیداتیوی ایجاد میکند که صدمه قلبی ایجاد میکند. این گروه مشخص کردند که در صورت مصرف دهانی 2-AB، این ماده باعث افزایش غلظت گلوتاتیون در جریان خون و قلب شده و باعث تخفیف صدمات ایجاد شده با دوکسوروبیسین میشود (شکل۲)
نتایج این تحقیق نشان میدهد علاوه بر اینکه 2-AB یک بیومارکر است، بصورت یک آنتیاکسیدانت نیز عمل میکند. 2-AB یک آمینواسید طبیعی است که در بسیاری از موادغذایی یافت میشود. تحقیقات بعدی میتواند موادغذایی با مقادیر بالای 2-AB و مقادیر پیشنهادی دریافت آن را مشخص سازد. همچنین میتواند در مورد مصرف آن بهعنوان یک آنتیاکسیدانت برای ارگانهای مختلف و داروهای مختلف راهگشا باشد.
منابع:
Yasuhiro Irino et al. 2-Aminobutyric acid modulates glutathione homeostasis in the myocardium, Scientific Reports (2016). DOI: 10.1038/srep36749