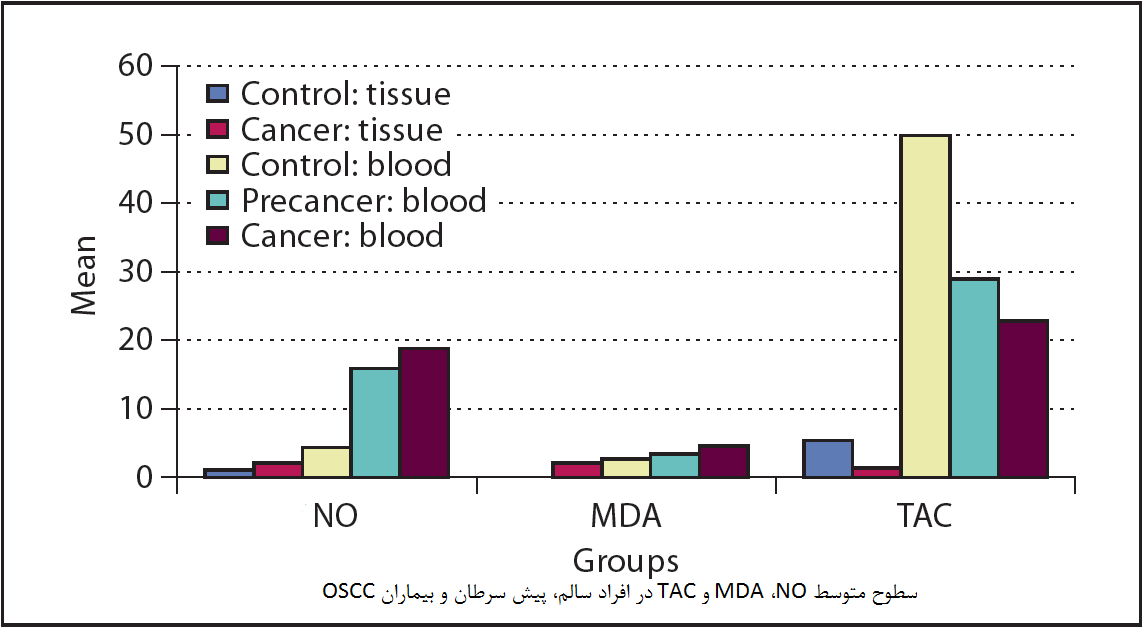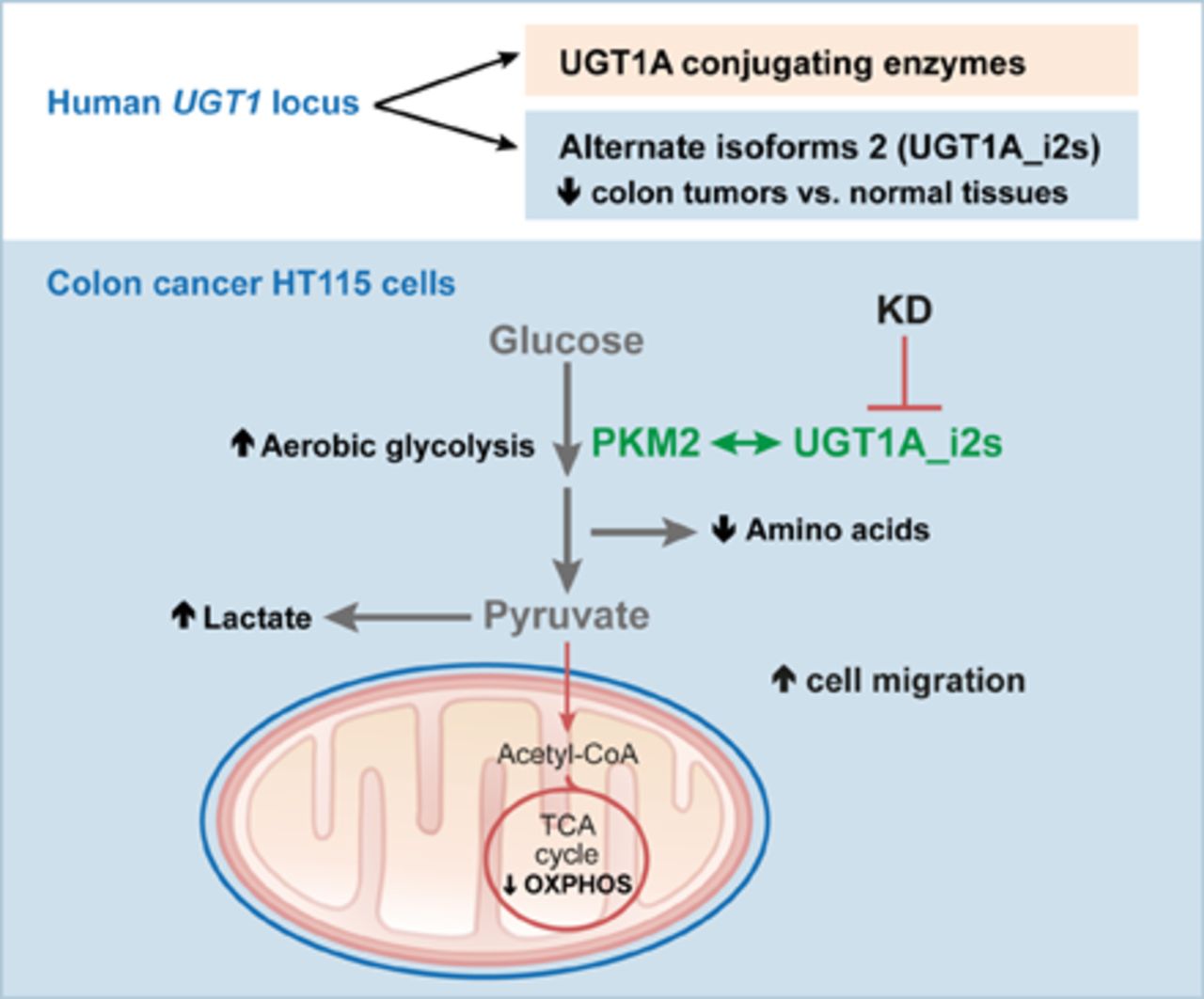
گرافن ها بر اساس خصوصیات الکترومکانیکی خود و با توجه به خاصیت ثابت نگه داشتن سلولهای بنیادین سرطانی ترکیباتی منحصر به فرد تلقی می شوند. راهکارهای درمانی قدیمی سرطان با استفاده از شیمی درمانی و پرتودرمانی به عنوان اولین متد درمانی سرطانها در درمان انواع سرطانهایی که در آینده با آنها مواجه خواهیم شد ناتوانند. سلولهای بنیادین سرطانی یا CSCs قابلیت زنده ماندن و رشد و تکثیر در بازیابی ساختار تومور، متاستاز و مقاومت در برابر دارودرمانی می شوند. محققان دانشگاه منچستر و کالابریا به تازگی پی به خنثی و اکسید شدن CSCs توسط گرافنها به روشی نامشخص می شوند.
یک سلول بنیادین سرطانی به تنهایی قادر است توده ای از سلول های بنیادین سرطانی را با نام تومور- اسفر یا سلولهای سرطانی جدید مانند آنچه که در متاستاز مشاهده می شود تشکیل دهد. این سلولها نامیرا، دارای سرعت تکثیر بالا و مقاوم به استرس می باشند. برای این منظور اکسید گرافن (GO) که فرم اکسید شده کربن بوده و قابلیت انحلال در حلالهای متفاوتی را دارد به خوبی شناخته شده است.
برای بدست آوردن یک نگاه کلی از تاثیر متقابل اکسید گرافن بر روی سلولهای سرطانی محققان از سلولهای بنیادین سرطانی برگرفته از ۶ مدل سرطان پستان، پانکراس، ریه، مغز، تخمدان و پروستات و همچنین سلولهای طبیعی پوست را برای اثبات عدم آسیب سلولهای طبیعی تحت تاثیر اکسید گرافن استفاده نمودند.
پس از اینکه سلولها به مدت ۴۸ ساعت در معرض محلول اکسید گرافن قرار گرفتند، محققان دریافتند اکسید گرافن نه تنها موجب ممانعت از شکلگیری تومور اسفر شدند بلکه نسبت به سلولهای سالم پوست نیز بیتاثیر بودند.
سرپرست محققان اذعان داشت:
به نظر میرسد GO تبدیل سلولهای بنیادین سرطانی را به سلولهای بنیادین غیرسرطانی القا میکند. در این راستا، GO بطورموثری مانع تجمع سلولها بنیادین سرطانی میشود. در حال حاضر تئوری محققان برپایهی تداخل GO با مسیرهای سیگنالینگ غشای سلولهای سرطانی و محدود نمودن مکانیسمهای تکثیر آنها استوار است.
نکته جالب اینجاست که، این مشتقات گرافن تا پیش از این به عنوان حامل داروها در تومورها مورد مطالعه قرار گرفته است، اما امروزه خود بطور مستقیم به عنوان یک عامل موثر در درمان تومور مطرح میباشد.
در عین حال که تاکید محققان بر روشن شدن مکانیسمهای اثر مواد در درمان تومورها می باشد، توانایی تخریب سلولهای بنیادین سرطانی توسط این مواد موردی مهم در پروتوکل درمانی به شمار میاید چرا که آنها قابلیت نابود کردن سلول های سرطانی و در نهایت ممانعت از متاستاز را ارائه میدهند.
منبع:
Fiorillo, M., Verre, A.F., Iliut, M., Peiris-Pagés, M., Ozsvari, B., Gandara, R., Cappello, A.R., Sotgia, F., Vijayaraghavan, A. and Lisanti, M.P., 2015. Graphene oxide selectively targets cancer stem cells, across multiple tumor types: implications for non-toxic cancer treatment, via “differentiation-based nano-therapy”. Oncotarget, 6(6), p.3553.