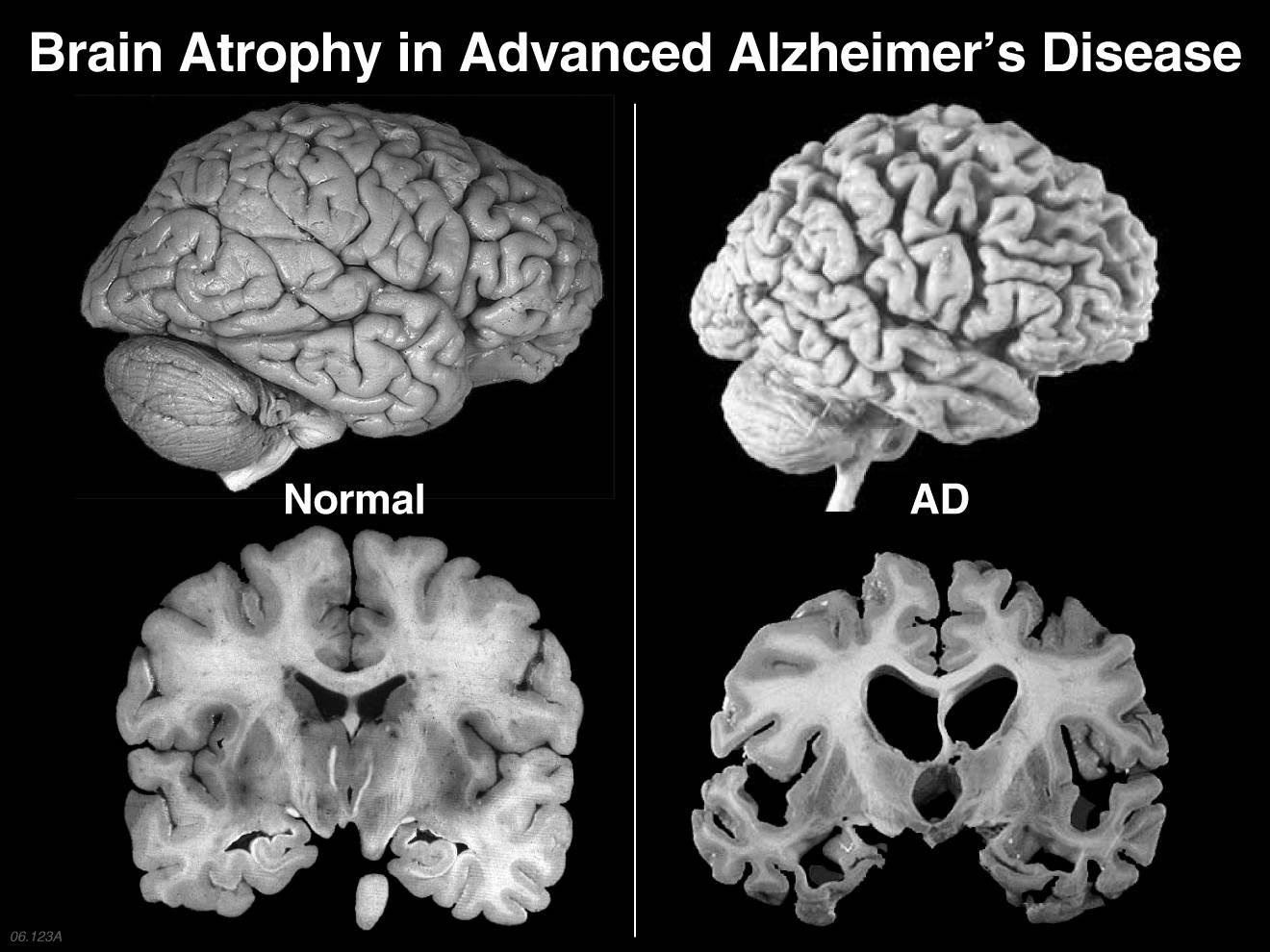
تحقیقات جدید نشان میدهند که چطور یک آنتیاکسیدان محافظ مغز میتواند از زوال عقل و آلزایمر جلوگیری کند.
آنتیاکسیدان سوپراکسید دیسموتاز یا SOD1 با رادیکالهای آزاد که باعث آسیب اکسیداتیو در مغز میشود، مبارزه میکند با این حال، یک تیم تحقیقاتی دانشگاه ایالتی آیووا، مزایای محافظتی SOD1 را به طور چشمگیری ضعیف میداند. درحالی که سطح پروتئینهای tau در بیماری آلزایمر افزایش مییابد اما بر اساس نتایج، محققان معتقدند SOD1 برای مقابله با اثرات مضر پروتئین tau مبارزه میکند اما در نهایت نبرد را از دست میدهد.
در افراد مبتلا به اختلال شناختی ضعیف و آلزایمر، SOD1 بیشتر به بخش خاکستری مغز مربوط میشود که نقش مهمی در حافظه دارد. با این حال، نتایج نشان میدهد 90 درصد از این تاثیر مثبت توسط tau از بین میرود. این مساله باعث نمیشود که سوپراکسیددیسموتاز به عنوان عامل منفی در آلزایمر شناخته شود، بلکه اثر پروتئین tau را در تشدید آسیب اکسیداتیو بیان میکند.
مکلیمانز، فارغ التحصیل PhD و دستیار تحقیق، علوم غذایی و تغذیه انسانی و بریجت کلارک، کارشناس تحقیقاتی دانشنامۀ سیکلون تابستان، این مطالعه را منتشر کردند که توسط مجله Antioxidants & Redox Signaling منتشر شده است. علاقه آنها به آنتیاکسیدانها که به طور طبیعی در بدن و در غذاها وجود دارد، منجر به بررسی این مساله شد که چگونه SOD1 پیری را تحت تاثیر قرار میدهد.
کلارک گفت: “این مطالعه میتواند بیشتر به بررسی نحوه کاهش میزان تغذیه و جلوگیری از تولید عصبی و پیری در مغز مربوط شود. Auriel Willett استادیار علوم غذایی و تغذیه انسان، که به تحقیق نظارت داشت بیان میکند که میزان پروتئین SOD1 و tau در افراد با درجههای مختلف بیماری آلزایمر متفاوت است. محققان آزمایشهای بالینی را بر روی بزرگسالان محدوده سنی 65 تا 90 ساله مبتلا به آلزایمر در زمینه ابتلا به بیماریهای عصبی، مورد مطالعه قرار دادند. از 287 نفر در این مطالعه، 86 نفر اختلال شناختی داشتند، 135 نفر اختلال خفیف داشتند و 66 نفر مبتلا به بیماری آلزایمر بودند.
مک ليمانس گفت، بسياری از محققان آزمایشات خود را در زمینهSOD1 و مغز بر اساس تحليل مغز پس از مرگ مبتلایان به آلزايمر انجام میدهند. طبق همین بررسیها تاثیر SOD1 در آلزایمر و تاثیر بیومارکرها در مغز و مایع مغزی نخاعی در بزرگسالان مشخص شده بود. امروزه تحقیقات بیشتر، نقش پروتئین tau را در توسعه آلزایمر نشان میدهد. Willette گفت: “بیماری ممکن است تا حدی شروع شود یا پیشرفت کند، زیرا آنتیاکسیدانها در مغز ما کارآیی خود را هنگام افزایش آسیب اکسیداتیو، افزایش میدهند.”
محققان در ایالت آیووا میگویند مطالعات بیشتری نیاز است تا تعیین کند آیا افزایش تولید SOD1 احتمالا از طریق رژیم یا دارو ممکن است به پیشرفت بیماری آلزایمر تاثیر داشته باشد یا خیر؟
منابع:
McLimans, K.E., Clark, B.E., Plagman, A., Pappas, C., Klinedinst, B., Anantharam, V., Kanthasamy, A. and Willette, A.A., 2019. Is CSF SOD1 a Biomarker of Tau but not Amyloid Induced Neurodegeneration in Alzheimer’s Disease?. Antioxidants and Redox Signaling,