مطالعات زیادی نشان دادهاند که آنتی اکسیدانتها مانع از پیشرفت سرطان میشوند. مطالعه جدیدی از آکادمی سالگرنزکای دانشگاه گوتنبورگ سوئد نشان داده است که ممکن است این مواد باعث تسریع پیشرفت سرطان ریه شوند.
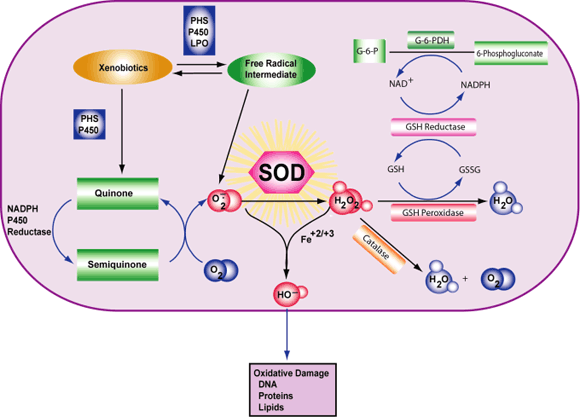
آنتیاکسیدانتها مواد شیمیایی هستند که در برخی مواد دارویی، غذاها و افزودنیهای خوراکی وجود دارند. در بدن، آنتیاکسیدانتها با رادیکالهای آزاد مقابله و آنها را خنثی میکنند. رادیکالهای آزاد موادی هستند که بصورت بالفعل برای سلولها مضرر هستند.
با وجود اینکه رادیکالهای آزاد بصورت طبیعی در بدن تولید میشوند و در بسیاری از روندهای طبیعی بدن نقش ایفا میکنند، در مقادیر بالا میتوانند باعث تخریب محتویات سلول از جمله DNA، پروتئین و غشای سلول شوند. این روند ممکن است باعث بروز سرطان شود.
مطالعات آزمایشگاهی بر روی حیوانات نشان داده است که آنتی اکسیدانتها میتوانند برخی از انواع آسیبهای سلولی ناشی از سرطان را بهبود بخشند اما مطالعه جدید دانشمندان سوئدی خلاف این فرضیه را عنوان کرده است.
آنتیاکسیدانتها مانع از فعال شدن پروتئین p53 میشوند
این تیم پیشرفت تومور را در دو گروه از موشهای مبتلا به سرطان ریه مورد بررسی قرار دادند.
یکی از گروهها در رژیم غذایی خود ویتامین E و استیل سیستئین دریافت نمودند. مقادیر دریافت برمبنای مقادیر نرمال دریافت این مواد در رژیم غذایی انسان همسانسازی شد. گروه دیگر رژیم غذایی مشابه اما فاقد آنتیاکسیدانتها را دریافت کردند.
محققین دریافتند که موشهای دریافت کننده آنتیاکسیدانت اضافی، ۳ برابر بیشتر تومور داشته و ۲ برابر سریعتر از گروه مورد مقایسه تلف شدند.
علاوه بر این موشهای دریافت کننده آنتیاکسیدانت اضافی، تومورهای بزرگتری نسبت به گروه کنترل داشتند.
پروفسور برگو، رهبر این تیم تحقیقاتی، مکانیسم پیشرفت تومور را چنین ارزیابی میکند:
هنگامی که آنتیاکسیدانتها به رادیکالهای آزاد حمله میکنند پروتئینی تحت عنوان p53 غیرفعال میشود. این پروتئین اثر خنثیسازی تومورها را بر عهده دارد و در صورت حذف آن تومورها با سرعت و تهاجم بالاتر رشد میکنند.
پیامدهایی برای بیماران مزمن ریوی
این دانشمندان یادآور شدند که استیل سیستئین آنتیاکسیدانتی است که بیشتر توسط بیماران مبتلا به بیماری مزمن احتقانی ریوی (COPD) مورد استفاده قرار میگیرد، این آنتیاکسیدانت قابلیت حل موکوس را دارد.
پروفسور برگو در مورد پیامدهای این یافته برای بیماران ریوی میگوید:
بسیاری از بیماران COPD سابقه استعمال دخانیات داشته و بنابراین ریسک بالاتری برای ابتلا به سرطان ریه دارند. برای توصیه به این بیماران در خصوص مصرف استیل سیستئین بسیار زود است اما مطالعه ما نکات شفافی را مشخص نموده که نیاز به مطالعه بیشتری در این زمینه وجود دارد.
با این وجود پروفسور لیندال از همین تیم تحقیقاتی عنوان میکند که بیماران COPD نباید با تکیه بر یافتههای مطالعه ما دریافت استیل سیستئین را متوقف کنند. او تاکید میکند که مطالعه حاضر ریسک بروز سرطان را مورد بررسی قرار نمیدهد، بلکه میزان تاثیر آنتیاکسیدانتها بر نحوه پیشرفت سرطانی که وجود دارد را مورد بررسی قرار میدهد.
این تیم تحقیقاتی در نظر دارد در مورد میزان تاثیر آنتی اکسیدانتها بر انواع دیگر سرطان متمرکز شود. همچنین آنها علاقمندند که در خصوص نقش آنتیاکسیدانتها در بروز سرطان در موشهای سالم تحقیق کنند.
بلاگ نوند سلامت قبلا در خصوص اثر استرس اکسیداتیو بر سرکوب تومور مطلبی منتشر نموده است
منابع
Sayin VI, Ibrahim MX, Larsson E, Nilsson JA, Lindahl P, Bergo MO. Antioxidants accelerate lung cancer progression in mice. Science translational medicine. 2014 Jan 29;6(221):221ra15-.